RAAS与RAAS抑制剂
王教授首先详细阐述了RAAS的调节机制以及RAAS抑制剂在心血管疾病治疗中的作用机制。RAAS主要组分包括肾素、血管紧张素原、血管紧张素Ⅰ(Ang Ⅰ)、血管紧张素转换酶(ACE)、血管紧张素Ⅱ(Ang Ⅱ)、血管紧张素Ⅱ Ⅰ型(AT1)受体和Ⅱ型(AT2)受体等。RAAS不仅是一个循环内分泌系统,而且还存在于许多局部组织,参与调节血管张力、水钠代谢、细胞增殖等多重病理生理过程。血管紧张素原在肾素的作用下转化为Ang Ⅰ,继而在ACE的作用下转化为Ang Ⅱ,Ang Ⅱ的AT1和AT2受体之间相互拮抗。当Ang Ⅱ与AT1受体结合,其作用为促进血管收缩、细胞增殖、基质形成以及促进醛固酮分泌等;当Ang Ⅱ与AT2受体结合,其作用为血管舒张、抗增殖和凋亡等。RAAS过度激活产生的Ang Ⅱ除导致血压升高外,还会引起一系列心血管病理改变,包括动脉粥样硬化、心室肥厚和重构、炎症、纤维化等,最终将导致冠心病、心肌梗死、慢性心力衰竭(心衰)等心血管疾病的发生发展。
阻断RAAS的血管紧张素转换酶抑制剂(ACEI)和Ang Ⅱ受体(AT1)拮抗剂(ARB)主要通过阻断上述环节的不同靶点来减少Ang Ⅱ的生成或阻断其发挥不良作用。此外,ACEI除阻断Ang Ⅰ转换为Ang Ⅱ之外,还可激活缓激肽系统,通过2型受体(B2R)使一氧化氮生成增加,从而发挥舒张血管等作用。
ACEI临床应用剂量探索
接下来,王教授介绍了临床上常见ACEI的应用剂量。ACEI临床剂量的探索经历了漫长的过程,以卡托普利为例,1979年首次用于高血压治疗时采用的剂量较高,最高可达1000 mg/d,虽取得了较好的降压效果,但副作用明显,经过大量研究探索尝试,在7年之后才摸索出其150 mg/d的平均剂量是可长期治疗的合理剂量。其他ACEI的临床剂量目前也已明确,如贝那普利为10~40 mg/d,最大剂量可达80 mg/d。为最大程度阻断RAAS,同时确保安全性,应尽可能使用ACEI优化剂量。
RAAS抑制剂对临床终点事件的影响
已有大量临床研究探索了ACEI/ARB对临床终点的作用。荟萃分析显示,与利尿剂/β受体阻滞剂相比,ARB可显著降低致死性和非致死性卒中风险达24.4%(P =0.0002)。ALLHAT研究显示,与钙通道阻滞剂相比,ACEI可显著降低高危高血压患者心衰风险13%(P =0.007)。ONTARGET研究显示,与ACEI相比,ARB预防心血管疾病高危患者卒中作用略强(风险降低9%),但预防心肌梗死(风险增加7%)和心衰住院(风险增加12%)的作用较弱,但差异均未达到统计学意义。有研究显示,与其他干预措施相比,ACEI/ARB降压幅度越大,其降低终末期肾病(ESRD)风险和减少蛋白尿的效果越好。但在逆转左室肥厚方面,Yasunari等研究发现,尽管缬沙坦与氨氯地平降低高血压患者血压的疗效相当,但缬沙坦逆转左室肥厚的效果显著优于氨氯地平,治疗8个月时左室质量指数(LVMI)分别降低16%和1.2%(P <0.01)(图1),这提示ARB逆转左室肥厚的作用独立于其降压作用之外。Ding等的meta分析显示,与β受体阻滞剂相比,ACEI和ARB降低中心动脉收缩压和反射波增强指数的效果均显著更佳。
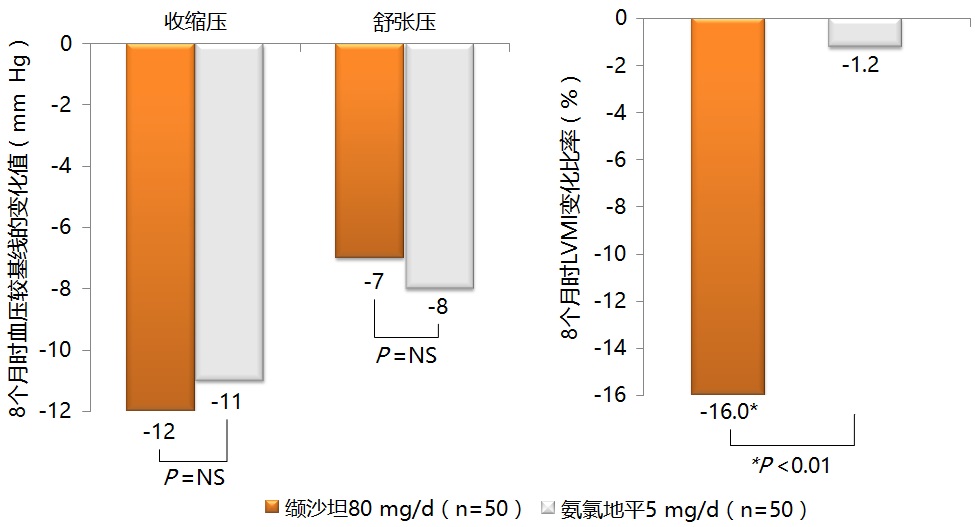
图1. 缬沙坦逆转左室肥厚显著优于氨氯地平
小 结
王教授最后指出,高血压作为一种心血管综合征,应从多方面进行评估。其并发症包括卒中、心衰、心肌梗死、ESRD等,亚临床疾病包括动脉粥样硬化斑块或内膜中层厚度增加、心电图或超声心动图异常、白蛋白尿或肾小球滤过率下降等,合并症则包括糖尿病、慢性肾脏病、痴呆、心房颤动等。从原发性高血压的发病机制来看,ACEI/ARB可同时干预动脉硬化和代谢综合征两个环节,在高血压乃至心血管疾病的治疗中均具有重要作用。