正方观点:UA是否应退出历史舞台尚有待论证
UA的历史及其与MI的关系
两个世纪以前, SA被描述为由劳累所诱发,主要原因是冠状动脉管腔狭窄引起的胸痛症状短时发作。上个世纪,稳定性心绞痛(Stable Angina,SA)和急性心肌梗死(AMI)被逐渐认知和诊断,二者的病理过程都以动脉粥样硬化为基础,但却有区别。1937年Sampson等学者提出,静息时严重的心绞痛患者与SA患者不同,但未达到AMI诊断,二者区别开始模糊。这种处于SA和AMI之间灰色区间,又称中间综合征。UA是介于SA和AMI之间一组临床综合征,有发展为AMI或猝死风险。起初,UA被描述为一种疾病,当时认为相当罕见,后来有些专家质疑其存在。在1956年,Friedberg在心脏病学著作中描述,UA患者为一种混杂群体,应归类为SA或心肌梗死(MI)。1971年WHO报道,急性冠状动脉综合征(ACS)是以冠状动脉粥样硬化斑块破裂或侵蚀,继发完全或不完全闭塞性血栓形成为病理生理的一组临床综合征,其历史上出现两个重要事件,一是WHO陈述了AMI诊断标准,二是Fowler和Conti等引用了UA这个术语,用于心绞痛和MI之间区域的称谓。
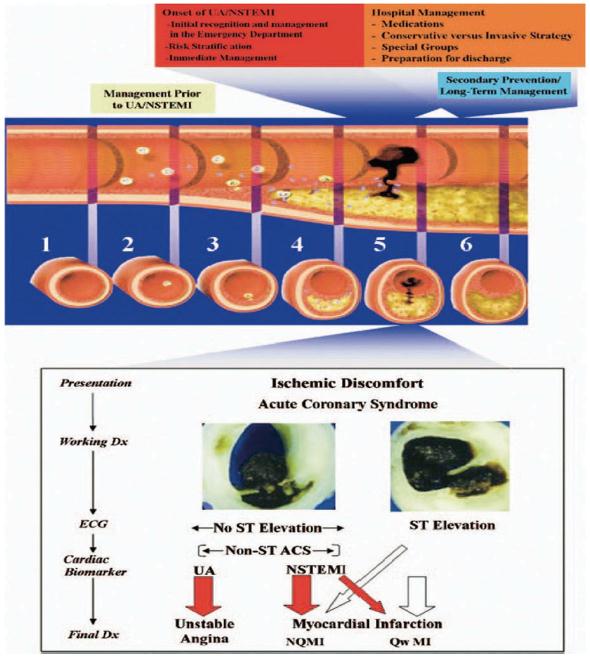
随着冠心病药物和介入治疗发展,UA已是十分常见疾病。1991年据美国健康统计中心报道,每年超过57万人因UA住院,意味着UA成为住院常见病。1994年Braunwald 等第一次发布UA诊疗指南,其诊断有三个特征:静息时心绞痛、新发严重劳累性心绞痛、先前SA的性质更剧烈。根据WHO定义,如无新Q波出现或QRS波改变及无心肌酶学升高,通常可除外MI,但有些患者临床表现与UA相似,且有典性心肌酶学动态改变,考虑心肌坏死,如无新Q波出现,考虑诊断非Q波MI,即后来定义为NSTEMI。本世纪初,ACS定义包括UA、NSTEMI和ST段抬高心肌梗死(STEMI),其中UA和NSTEMI有相似临床症状和心电特征,共同组成非ST段抬高ACS(NSTE-ACS),因此,心绞痛和MI之间含糊不清的情况开始逐渐定义为UA。
2008年WHO对MI定义进行修订:新发心肌缺血、原有缺血症状加重或心电图示心肌缺血改变,伴心肌酶学指标正常,应诊断为UA。在新发心绞痛、恶化心绞痛和UA之间区别显然是很难的,主要结合临床评估、辅助检查和病史,因此,UA需要进一步彻底划清与SA和MI关系。
病理生理机制与预后价值
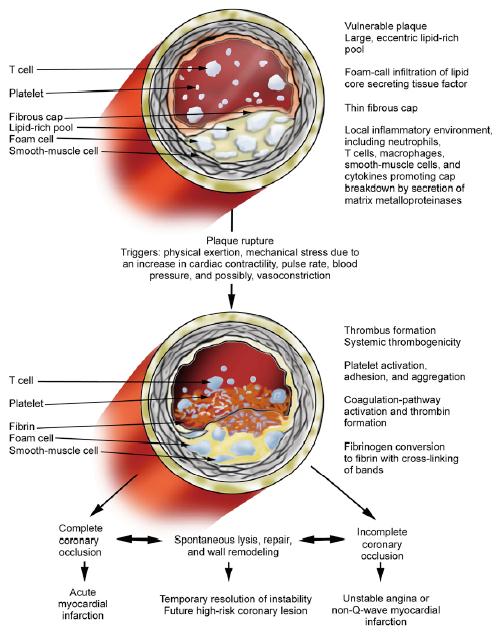
冠心病包含了两种相对独立的临床病理形式。一种呈慢性病程,即SA,由于动脉粥样硬化病变逐渐进展而使冠状动脉发生一定程度狭窄,主要表现为心肌需氧量增加而诱发的劳累性心绞痛。另一种呈急性病程,ACS是由于斑块破裂和糜烂并发血栓形成、血管痉挛及微血管栓塞等因素作用下所导致急性或亚急性心肌供氧减少,或多数病例事先可无严重狭窄病变,但主要原因为不稳定斑块,其特点为脂质核心大,纤维帽较薄,平滑肌细胞少而多炎性细胞浸润而易于破裂,进一步激活血小板和血栓形成,表现为UA、NSTEMI或STEMI、猝死等临床综合征。引起UA的冠状动脉斑块经历破裂和修复的反复过程,其过程中血栓形成和/或炎症起到主要作用,导致斑块不稳定,单核细胞侵润着斑块和血栓。因此,UA和MI的病理机制可能是一致的,或可能是一种疾病非常临近的两个阶段,但无法彻底分割。
根据加拿大心血管学会(CCS)心绞痛分级,UA分级高的冠状动脉斑块形态与MI冠状动脉斑块形态相似,而UA分级低的冠状动脉斑块形态与SA的相似。因此,从病理生理机制上看,这些重合并不能使得冠心病分类轻易改变,更重要的是临床的指导意义和预后价值。
UA的诊断与治疗
静息时出现心绞痛患者不伴心肌肌钙蛋白(cTnI)升高,则考虑诊断UA,而已诊断UA患者检测hs-cTn升高,则原诊断UA患者重新归类为NSTEMI。多项研究表明,高敏肌钙蛋白(hs-cTn)超过参考值上限,这些患者发生心血管死亡和MI的风险比未超过参考值的患者风险显著增加。如果取消UA,hs-cTn升高就诊断NSTEMI或MI,反之,就可诊断心绞痛,可能会减少对UA和NSTEMI分类的困扰,而使更多患者临床获益,但那些hs-cTn阴性的UA患者按照SA治疗可能会低估病情或推迟早期干预,hs-cTn升高就诊断NSTEMI或MI可能导致MI的过度诊断,所以,目前UA“退隐江湖”可能不为时过早。
在治疗方面,STEMI治疗首要原则是实施再灌注治疗,即行冠状动脉介入治疗或溶栓治疗,无论cTn值高低。现在诊断低危的NSTEMI(cTn阳性/CK-MB阴性)患者,在高敏肌钙蛋白检测时代之前,均诊断UA,诊断不同导致治疗目标和策略有差别。NSTEMI患者治疗目标是预防再次MI及保护心功能、抗血小板治疗等,而UA主要是预防MI发生、抗血小板、他汀类药物等治疗。因此,保留UA的诊断是细化临床策咯的基础,高敏肌钙蛋白检测提供了重要的帮助。废除UA诊断,可能给临床诊疗工作带来很多不便。未来冠心病否可能重新分类,UA是否退出历史舞台,尚待研究论证。
反方观点:UA是应该彻底退出历史舞台了
心肌坏死标志物的局限性
肌酸激酶同工酶 1980年和1990年,肌酸激酶同工酶(CK-MB)认为是最敏感和最特异心肌标志物。UA和NSTEMI诊断都有典性静息时心绞痛症状和心电缺血改变,唯独区别在于心肌坏死标志物是否升高,CK-MB升高诊断NSTEMI,否则为UA。通常在NSTE-ACS患者中没有检测出CK-MB升高,且不能除外NSTEMI诊断则考虑诊断为UA。与UA伴无CK-MB升高相比,NSTEMI 患者有CK-MB典性动态改变为特征,具有较高死亡率和预后不良。检测CK-MB有一定不足,仅依赖CK-MB诊断是否为MI,UA较高的发病率似乎被高估,区别UA和NSTEMI有重要临床意义。CK-MB在其他疾病也升高,易误诊为MI;但CK-MB升高和下降也是有时限的,如果ACS患者过早筛查,CK-MB未升高可能原本诊断NSTEMI而误诊断为UA,需动态监测,而患者过晚筛查,CK-MB值原本升高而下降现为正常,原本诊断NSTEMI患者现误诊断为UA,可能低估患者风险。综上,CK-MB是鉴别UA和MI的一个指标,但有一定局限性,也无法精确分类。
心肌肌钙蛋白 随着心肌标志物检测技术发展和指南更新, cTn已取代CK-MB作为心肌坏死标志物筛查首选。CK-MB与其他心肌坏死标志物相比有绝对优势,但缺乏最佳敏感性和特异性。1987年Cummins 等和Katus等分别提出了心肌肌钙蛋白I(TnI)和心肌肌钙蛋白T(TnT)均作为心肌坏死标志物,其敏感性和特异性均优于CK-MB,诊断心肌坏死更准确和快速,有助于MI诊断。TIMI3研究提示,UA伴未CK-MB升高的患者中有25%患者检测cTn升高,这部分人重新诊断为NSTEMI,使诊断MI患者数量显著增加。2000年ACC/AHA发布的NSET-ACS指南指出,据估计大约1/3UA伴CK-MB正常的患者存在cTn升高,仍应归类于NSTEMI,由此可见,UA患者中“伪装”了部分NSTEMI患者,UA与NSTEMI有密切联系。Hamm等修订了先前UA分类方法,将ⅢB类心绞痛,即48h存在静息性原发性心绞痛的患者根据cTn阳性和阴性再分成两类,两者30天心脏死亡或MI的发生率分别为15%~20%和<2%,而据新的MI定义可知,ⅢB类cTn阳性患者已归类为NSTEMI的范畴。早期单靠检测CK-MB来诊断NSTEMI和评估患者预后,但会使部分患者误诊UA,再次分类诊断有着重要的临床价值,因CK-MB正常伴cTn升高的患者与无任一升高的患者相比,其预后不良,且属心脏不良事件发生的高危人群。有研究显示,早期检测cTn升高的ACS患者经低分子肝素、Ⅱb/Ⅲa受体拮抗剂或介入治疗后,病死率和MI发生率显著下降,因此,cTn升高的ACS患者提示有高危风险,因早期积极干预而获益。cTn的检测对于ACS患者临床预后有预测价值,及对ACS患者危险分层有重要意义。对UA和MI患者,治疗及预后有一定区别,真正的诊断尤为重要,但是,cTn检测能彻底对UA和MI分类吗?
肌钙蛋白检测也存在局限性,cTn早期数小时内敏感性不足,并非心肌损伤所独有或存在假阳性,如肺栓塞、败血症、慢性肾病等可以检测到,SA患者合并其中一种疾病可能出现cTn阳性,此时易误诊成MI。cTn检测灵敏度逐渐增加,使UA患者一部分再分类诊断为NSTEMI,又把UA推向“悬崖边缘”。总之,cTnI检测影响着UA和NSTEMI分类诊断,UA中部分患者将再次归类为NSTEMI,使“UA世界”进一步减少,甚至边缘化。
高敏心肌肌钙蛋白 hs-cTn检测方法出现以来,cTn检测范围上限值越来越低。hs-cTn检测显著地增加从UA患者中诊断为NSTEMI患者数量,真实世界UA患者越来越少。UA诊断可能不是固定的,而是其中可能涵盖部分NSTEMI或演变成MI,真实世界中可能仅有很少的UA患者,又将UA进一步推向消失的边缘。
随着hs-cTn检测灵敏度增加,有助于早期MI诊断,但AMI诊断的特异性也随之下降。hs-cTn可见于临床多种疾病如稳定性冠心病、心力衰竭、心室肥厚、结构性心脏病、肺栓塞、败血症等等。健康人群中可以检测到hs-cTn升高,具体原因尚未阐明。此外,由于hs-cTnT检测会有较低的阈值,诊断准确性可能会有所降低。hs-cTn检测灵敏度增加,进一步使UA区域变得狭小,且可能导致心绞痛和MI分类混乱。检测心肌标志物是标志着心肌损伤或坏死,可影响UA和NSTEMI分类,使UA边缘化或MI过度诊断。心肌坏死标志物可指示心肌损伤或坏死,但不可仅依赖检测确定疾病诊断,需临床综合评估。
UA的影像学评价已经趋于模糊
冠状动脉造影被誉为冠心病诊断的“金标准”。冠状动脉病变形态根据美国心脏病学学会和美国心脏协会(ACC/AHA)分性标准分为A、B、C性。SA的冠状动脉造影示,多以A性病变为主,病变范围局限、管壁光滑,无或仅有轻度钙化,多为同心性病变,极少有血栓。UA病变形态以C性多见,病变范围弥散,偏心不规则狭窄和闭塞病变多见,钙化较严重,血栓检出率高,病变多复杂。NSTEMI造影多为多支血管病变、钙化病变、弥漫长病变,多伴侧支循环,血栓发生率高等,而STEMI多为病变本身不复杂,血栓发生率高,闭塞病变或次全闭塞等特点。因此,UA和NSTEMI冠状动脉造影病变特点有相似之处。血管内超声(IVUS)可以在血管横断面上精确显示斑块形态和组成。UA的IVUS特征多为内膜夹层/破裂、正性重构、以脂质斑块为主,较大斑块负荷及低回声斑块、血栓等,与NSTEMI几乎相似;SAIVUS特征多为硬斑块、钙化多见,偏心病变等。综上,UA与NSTEMI影像学特征多有相似,是否从影像学特点重新分类为SA和MI两类呢?
近年来无论是美国还欧洲发布UA/NSTEMI治疗指南主要是抗血小板、他汀类药物、抗凝、介入治疗或冠状动脉旁路移植术等建议,它们在危险分层、治疗等建议都是共同列出,似乎已经把UA/NSTEMI作为一种疾病管理。UA和NSTEMI治疗策略几乎相同,是否可把UA归为NSTEMI或取消UA诊断呢?
本刊评论:UA的当今问题及对策
UA不是一独立疾病,而是一临床综合征,指介于SA和AMI之间的、一系列有症状心肌缺血征候群,其临床表现和病情差异很大。UA的自然病程取决于冠状动脉病变的程度和范围、是否有伴发病、年龄、缺血性疼痛的性质(从较轻的单纯初发心绞痛到严重的静息心绞痛)、是否有左室功能不全以及药物治疗的疗效。随着治疗学的进展,其转归已大为改观。
UA的发病机制
UA是急性心肌缺血的临床表现,这是活动性冠状动脉斑块内所发生的病理生理事件累积的结果。随着对这些病理生理过程认识的深入,仅单纯对冠状动脉造影所见斑块的形态学描述是不够的,更重要的是要探索斑块的细胞生物学行为。这一领域的知识已有长足发展,同时也促进了循证治疗的进步。
冠状动脉粥样硬化进展所致的管腔进行性狭窄是UA发病机制之一。早期对UA血管造影的研究几乎无一例外地观察到阻塞性粥样硬化病变的存在,这为冠状动脉血运重建提供了理论基础。然而,就病变血管的程度和数目来讲,UA和SA及心肌梗死冠状动脉造影所见并无明显区别。UA患者之间,冠状动脉病变程度的差异也很大,轻者可无明显的狭窄,重者可有左主干病变(占5~10%),也可是单支病变(占20%),双支病变(占30%)或三支病变(占40%)。相对于SA来讲,UA血管狭窄程度常是轻中度狭窄,但侧支循环欠发达。因此,冠状动脉的固定狭窄程度不能完全解释UA的成因。
粥样硬化斑块突然破裂,并在此基础上形成血栓,冠状动脉固定狭窄加重,在UA发病中起关键作用。不稳定粥样硬化斑块内胆固醇和胆固醇酯含量增多、纤维帽薄弱、结缔组织和平滑肌细胞减少以及炎症浸润是斑块脆弱易于破裂的内在固有因素;冠状动脉局部血流紊乱、压力变化等导致的剪切应力增加,引起斑块破裂。管腔不全阻塞,心肌血流减少,导致心肌缺血,但缺血尚未到引起心肌坏死的程度。提示斑块破裂并不是血栓形成的必须条件,必定还存在冠状动脉内血栓形成的其他触发因素。在UA,炎症反应常很强烈。引起炎症的确切机制仍不清楚,部分原因可能是免疫性的。刺激炎症反应的候选抗原有修饰的LDL、巨细胞病毒、肺炎支原体等。对不稳定斑块的病理检查发现有大量单核-巨噬细胞、肥大细胞、淋巴细胞和中性粒细胞浸润。活动性斑块的炎症反应涉及细胞间的相互作用、基质降解蛋白的分泌(如金属蛋白酶等)、以及细胞因子、致炎物质和多种生长因子的表达。炎症能激活冠状动脉内皮细胞,内皮功能不良诱发血栓形成;同时炎症局部产生的蛋白水解酶可降解斑块纤维帽,使斑块更不稳定,易于破裂,使SA演变为UA。
内皮细胞功能不良扩血管作用减弱和血小板释放的血管活性物质所致的血管收缩使血流进一步减少。血管内皮脱失和功能不良,NO和PGI2等扩血管物质产生减少,此外内皮功能不良使某些扩血管活性物质(如乙酰胆碱)的扩血管效应逆转为缩血管效应;另一方面,血小板激活和血栓形成后,血小板释放和产生多种缩血管物质,使冠状动脉在原有的固定狭窄基础上产生血管收缩,产生动力狭窄,冠状动脉血流进一步减少。冠状动脉固定性狭窄引起心肌供氧减少,在此基础上,如心肌耗氧量增加,如甲状腺机能亢进、感染、发热、心动过速等,会促使慢性SA发展为UA。
hs-cTn检测的指导意义
1975年前UA就已被描述,第一次出现却极少有人认知。SA和AMI二者之间灰区,现在定义为UA。多半个世纪以来,更多人认识UA定义,而在25年前,大约一半的NSTE-ACS患者应诊断为UA。然而,随着超敏感心肌坏死标志物的检测应用,尤其是hs-cTn检测,可使一部分UA重新分类为NSTEMI。2008~2009年WHO报告对MI修订指出:过去诊断为UA的患者基于现在诊断标准应该诊断为MI。在未来几年,随着高敏肌钙蛋白检测普遍应用,广泛MI定义的可能被接受。基于上述结果,UA定义可能进一步边缘化,其定义将依赖于高敏肌钙蛋白检测,UA这种术语将变得越来模糊和混淆不清。利用高敏肌钙蛋白检测时,也存在不足。正常健康人发现hs-cTn升高,而发生ACS事件患者却未发现hs-cTn升高,这些原因尚未阐明。因此,冠心病分类可能回到了“原地”,就是将再次分为比三个群体更大的原来两个群体即心绞痛和MI患者群体。一类心绞痛患者,根据CCS对心绞痛严重程度进行分类;第二类AMI患者,其AMI有三个普遍的定义:MI的类性(Ⅰ、Ⅱ等),ECG改变(如STEMI和NSTEMI),心肌坏死的程度(与cTn释放的量相关)。
UA的康复运动处方
根据ACC/AHA等冠心病康复和二级预防指南,UA明确属于运动试验及运动训练的临床禁忌症。根据UA危险分层、不同治疗策略及转归,采取不同的运动训练推荐。UA血运重建术(PCI或CABG)后,如病情稳定并除外禁忌症,在综合评估、危险分层基础上,实施运动试验制订个体化运动处方。一般在术后2~5周开始有氧训练。所有患者都应该根据运动中发生心脏事件的可能危险进行分层,从而确定运动期间的医学观察和心电监测力度。运动步骤包括三步:第一步为热身阶段,多采用低水平的有氧运动,约10 min左右。第二步为训练阶段?(20~60 min),每周3~5次,运动强度可以根据实际情况采用无氧阈法、心率储备法、靶心率法或RPE分级法进行确定。快走或踏车既容易耐受也可提供足够的运动强度。第三步为恢复阶段,约10 min。此期是从运动强度逐渐恢复的时期,持续低水平的运动如慢走或踏车。阻抗运动的时期选择:PCI治疗后至少3周,且应在连续2周有监护的有氧训练之后进行;MI或CABG术后至少5周,且应在连续4周有监护的有氧训练之后进行。每次8~10个肌群,每周2次。可选用哑铃或杠铃、运动器械以及弹力带等。
对于准备参加运动康复而前期没有进行运动试验评估的患者,应在密切观察下保守地开展运动训练。起始运动强度可以根据距心脏事件发生时间的长度、出院时间以及患者初始评估内容确定。一般初始运动强度为2~3 METs,时速每小时1~2英里或25~50 W的踏车阻力,对于无异常症状和体征者可以根据心电监测和RPE分级情况逐渐增加运动强度。对于未进行冠状动脉血运重建的低危患者,经积极的药物治疗及危险因素控制后,病情稳定3个月可以视为稳定型冠心病,经安全性因素评估后,可进行有医学观察和心电监测的有氧训练,并根据患者情况推荐低强度的抗阻训练。对于中高危UA患者,在积极循证药物治疗、心血管危险因素控制、症状稳定≥3个月基础上,通过体力活动咨询与评估,积极推荐适合的日常体力活动。

[下一页] [1] [2] [3]