李东野 潘德锋 徐州医学院附属医院
左室射血分数保留的心力衰竭(HFpEF)是由左室舒张期主动松弛能力受损和心肌顺应性降低导致舒张期充盈受限、心搏量减少、左室舒张期末压增高而发生的心力衰竭(简称心衰)。目前,作为一种与左室射血分数减低性心衰(HFrEF)不同的类型,HFpEF的治疗受到心血管医生关注,其治疗是依据临床研究证据还是坚持个体化尚存较大争议。本文就HFpEF的治疗取向进行辨证分析。
正方:HFpEF治疗的临床研究证据
目前,关于心衰的临床研究证据大多集中于HFrEF的治疗,HFpEF治疗的相关证据较少。通过美国国立卫生研究院网站检索,截至2012年共有26项临床试验探讨HFpEF的治疗,主要集中在以下几个方面:
1. ACEI/ARB
相关证据主要来自CHARM-Preserved、PEP-CHF和I-PRESERVE三项随机对照试验及瑞典心衰注册研究一项队列研究。
CHARM-Preserved试验 入选3023例HFpEF患者,结果显示,与对照组相比,坎地沙坦组的主要终点事件(心源性死亡或因心衰住院)无统计学意义(P=0.118),但因心衰住院例数明显降低(P=0.014)。
PEP-CHF研究 入选850例HFpEF患者,结果显示,与安慰剂组相比,培垛普利组的主要终点事件无统计学意义(P=0.055),因心衰住院率显著降低(P=0.033),6分钟步行试验距离明显增加(P=0.011)。
I-PRESERVE研究 入选4128例HFpEF患者,结果显示,与安慰剂组相比,厄贝沙坦组的主要终点(死亡及因心衰入院)及次要终点(死亡、CV死亡、心衰死亡/住院、CV死亡/心肌梗死/卒中、6分钟步行试验和BNP)均无明显差异,但在低NT-proBNP亚组,厄贝沙坦可较安慰剂显著降低心衰联合终点(P=0.001)。
瑞典心力衰竭注册研究 共纳入16 216例HFpEF患者,经1﹕1匹配后最终入选6658例患者。结果显示,在HFpEF配对人群中,接受与未接受RAS系统抑制剂(RASI)治疗患者的1年生存率分别为77%和72%(P=0.008)。整体HFpEF人群中,上述患者的1年生存率分别为86%和69%(P=0.001)。研究表明,接受RASI治疗与患者全因死亡率降低具有相关性。
2. β受体阻滞剂
相关证据主要来自SENIORS、J-DHF等研究。
SENIORS研究 共纳入2128 例年龄>70 岁的心衰患者, HFpEF患者的亚组分析显示,奈必洛尔组的全因死亡率及因心血管疾病住院治疗率与安慰剂组相比无统计学差异。
J-DHF研究(日本舒张性心衰研究) 入选245例HFpEF患者,结果显示,卡维地洛组与对照组的主要终点(心血管死亡)及复合终点(心血管死亡和因心衰住院)均无显著差异。但卡维地洛标准剂量组的复合终点较对照组明显减少(P=0.0356)。
3. 醛固酮拮抗剂
相关证据主要来自Aldo-DHF、TOPCAT等研究。
Aldo-DHF研究(醛固酮受体拮抗剂在舒张性心衰的应用) 入选422例HFpEF患者,主要复合终点是1年时的峰氧摄取量(Peak VO2)和舒张功能(E/e’)。治疗6个月及12个月时,与对照组相比,螺内酯组的E/e’显著改善(P<0.001),但峰氧摄取量无显著改善。6个月时,两组的左室质量指数下降幅度相近(P=0.16),6~12个月期间,螺内酯组该指数继续下降,与对照组相比有显著差异(P=0.009)。6个月时,两组的NT-pro-BNP浓度均下降,螺内酯组降幅更显著(P=0.09)。12个月时,两组的NT-pro-BNP浓度均上升,安慰剂组上升更明显(P=0.03)。两组的死亡率和入院率无显著差异。
TOPCAT研究 是一项有关螺内酯与安慰剂的随机对照研究,主要终点为死亡及因心衰入院。预计入选4500例HFpEF患者,目前已入组3200例患者,预计明年年底将公布研究结果,届时将为HFpEF的治疗提供更多循证支持。
4. 磷酸二酯酶-5抑制剂
RELAX研究(磷酸二酯酶-5抑制剂改善舒张性心衰患者的临床状态与运动能力试验),入选216例HFpEF患者,结果发现,与安慰剂组相比,西地那非组在最大氧耗量、6分钟步行距离、超声心动图的心脏结构、组织多普勒的血液动力学指标、心脏MRI的心肌结构以及神经内分泌的激活方面无改善,患者的症状、临床状态或生活质量也无改善。
5. 新型药物
主要包括新型双重神经激素阻断药物(血管紧张素受体/脑啡肽酶抑制剂ARNI)LCZ696和重组人松弛素-2 (Serelaxin)两类药物。
PARAMOUNT研究是有关LCZ696与缬沙坦的II期随机对照试验,共入选301例HFpEF患者,主要终点为第12周时NT-proBNP较基线的变化。结果显示,与缬沙坦相比,LCZ696显著降低NT-pro-BNP浓度,治疗12周后降幅23%(P=0.005),治疗36周降幅15%(P=0.20)。此外,与缬沙坦组相比,LCZ696组治疗36周时的NYHA分级、左房宽度、左房容积以及左房容积指数等指标均明显改善。LCZ696降低NT-pro-BNP、抑制左房重塑的作用令人鼓舞。
于2013年8月开始的PARAGON-HF研究旨在观察LCZ696与缬沙坦对HFpEF患者发病率及死亡率的影响,将为HFpEF的治疗提供更多临床研究证据。
双盲随机安慰剂对照试验RELAX-AHF研究入选射血分数正常的急性心衰患者,研究主要终点是第6小时、第12小时、第24小时和第5天时对呼吸困难的疗效,次要终点为60天内心血管死亡、因心衰或肾衰竭住院以及出院后存活天数。结果显示,与安慰剂相比,第5天时重组人松弛素-2(Serelaxin)能同等程度缓解HFpEF和HFrEF患者的呼吸困难,第一个24小时内对HFpEF患者疗效更好;两组患者的次要终点无差异。这提示,Serelaxin对HFpEF患者具有积极疗效。在HFpEF和HFrEF患者中,该药均能有效缓解呼吸困难,减少再住院率,提高生存率。
生活方式
Ex-DHF-P研究入选64例患者,主要终点为峰氧摄取量(Peak VO2),次要终点为心脏结构、左室舒张功能及生活质量。结果显示,与对照组相比,运动组的峰氧摄取量显著增加,E/e’和左房容积指数显著降低,生活质量(SF-36简易健康量表评分及MLWHFQ明尼苏达心衰调查表评分)显著改善(P值均<0.001)。
反方:HFpEF应个体化治疗
HFpEF个体化治疗的概念性基础
HFpEF与HFrEF在概念上的关键不同在于左室射血分数(LVEF)不同,超声心动图测定LVEF对两者的鉴别诊断尤为重要。此外,还应重点考虑患者是否伴有符合HFpEF的流行病学特点,如老年、高血压病史、女性、伴有糖尿病、心房颤动、肥胖、代谢综合征等。HFpEF的早期识别,有利于疾病早期防治。有多种合并症的HFpEF老年患者表现往往极为严重,比HFrEF更有可能死于合并症。
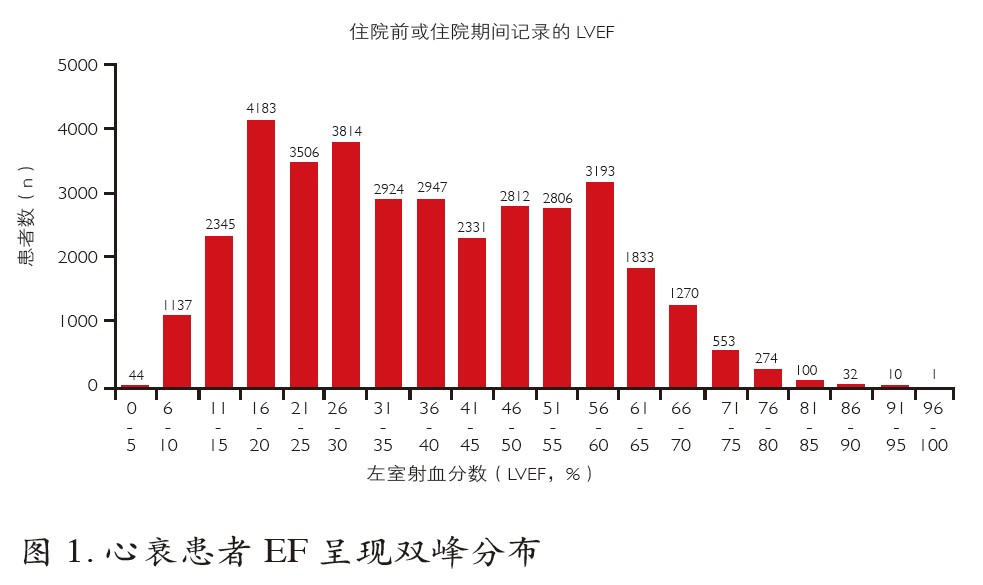
尽管HFpEF和HFrEF二者有共同临床特征,但却并非同一概念。若HFpEF和HFrEF属于同一种综合征(疾病),心衰人群EF应呈连续的单峰分布曲线。但OPTIMIZE研究显示,心衰人群EF呈现双峰分布(图1)。应用性别条形图表示后,这种双峰分布特征仍存在,且在女性更突出。 因此,HFpEF是独立于HFrEF的一种不同概念,HFrEF治疗的证据不适用于HFpEF患者,这是HFpEF个体化治疗的概念性基础。
HFpEF独特的病理生理机制——HFpEF个体化治疗的病理生理基础
近来研究发现,生物学特性(年龄和性别)和合并症(高血压、糖尿病、冠心病)决定心衰的发展轨迹,即心衰的异质性。 冠心病、心肌炎、1型糖尿病等所致心衰明显促进离心性肥厚,而2型糖尿病、肥胖、高血压、女性则明显促进向心性肥厚。组织病理学研究表明,HFrEF时心肌细胞变窄变长,肌纤维密度降低;而HFpEF时心肌细胞直径增加,静息张力增加。在器官水平上,心室腔离心性扩张是HFrEF的特征;相反,HFpEF的特征则是左室向心性重构,腔径小而压力高,心腔大小、收缩末和舒张末容积不变甚至降低,室壁厚度和重量增加,左室壁重量/体积比增加,左室舒张期末压升高,引起左房和肺静脉压升高,进而引起肺淤血。当血液动力学骤变时,肺血管的压力高于血浆渗透压,血管内的液体进入肺泡而发生急性肺水肿。 从病理生理机制来看,HFrEF和HFpEF具有明显差异,HFpEF病理生理过程中的异质性及发病机制的多样性是HFpEF个体化治疗的病理生理基础。
HFpEF不同于HFrEF的流行病学特点——HFpEF个体化治疗的流行病学基础
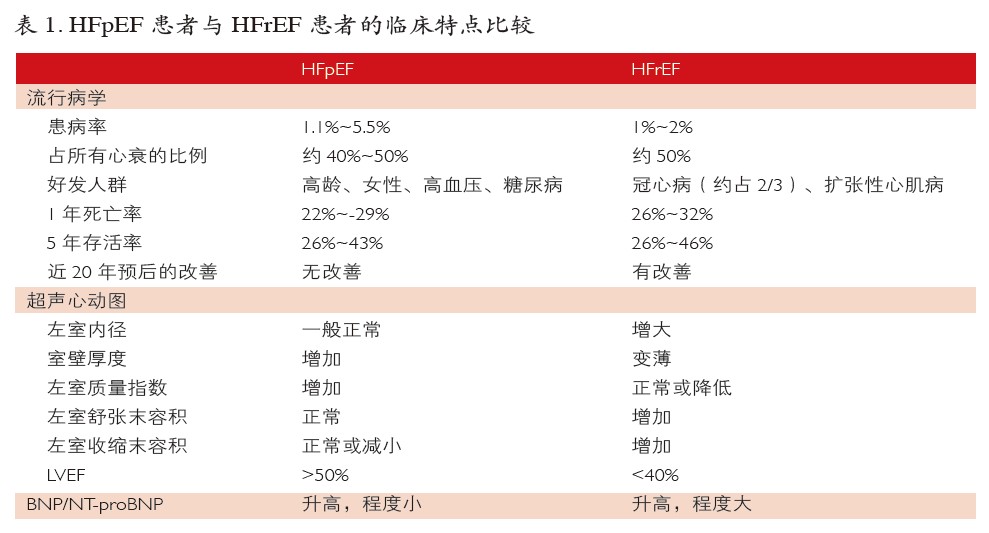
与既往认知相比,HFpEF人群发病率显著增高,预后也比预期差,应高度重视。MAGGIC研究对29项研究的荟萃分析表明,与HFrEF患者相比,HFpEF患者通常年龄更大,更多为女性,多伴有高血压病史,较少伴有缺血性心脏病,死亡率及死亡风险较低(见表1)。HFpEF患者病因及合并症的多样性是HFpEF个体化治疗的流行病学基础。
HFpEF治疗的临床研究证据不足——HFpEF个体化治疗的研究证据
如果 HFpEF 和 HFrEF 是同一综合征(疾病),相同的治疗方案应获得同等疗效。从治疗学的角度看,目前的临床研究证据表明,近20年来HFrEF的生存明显改善,而治疗HFrEF 的有效方案用于HFpEF 的结果却令人失望。
近期公布的瑞典心力衰竭注册研究、RELAX-AHF研究结果证实,ACEI/ARB及Serelaxin对HFpEF患者的死亡率有所改善,但其所提供的证据尚不充分,需进一步验证。CHARM-Preserved、PEP-CHF、I-PRESERVE、J-DHF、ALDO-DHF、PARAMOUNT、Ex-DHF-P等研究均未证实,传统常规治疗方案可降低HFpEF患者死亡率,但却先后证实ACEI/ARB、β受体阻滞剂、醛固酮拮抗剂等药物及运动锻炼等生活方式改变可降低心衰住院例数,降低NT-proBNP,利于左房重构,改善运动耐量及生活质量,为HFpEF患者针对病因及合并症的个体化治疗提供了证据支持。
目前,HFpEF的治疗很大程度是根据发病机制和收缩性心衰治疗方案而推论,多为经验性治疗。HFpEF的治疗可分为病因治疗、对症治疗和调节心肌功能异常的治疗三部分。从具体措施上,可分为非药物治疗和药物治疗两部分。其中,非药物治疗包括改善生活方式、适量运动、积极控制可能促发HFpEF失代偿的因素。药物治疗原则上要积极控制血压达标,控制心房颤动心率和或恢复维持窦性心律,针对患者具体情况个体化使用β受体阻滞剂、利尿剂、ACEI/ARB、醛固酮拮抗剂等药物。
HFpEF的处理策略
目前已有针对HFpEF的临床研究证据尚存争议,未得到满意研究结果。临床实践中,医生应如何决策? 2013 AHA心衰指南提出 “指南指导的药物治疗(GDMT)”代替“优化(最佳)药物治疗”的概念。GDMT的概念更为宽泛,包含更丰富内容。依据新指南作出调整的心衰优化治疗方案既包括生活方式调整(是药物治疗的基础与前提),又针对心衰基础病、合并症、并发症进行合理药物治疗。同时,在多种药物联用时还要考虑药物不良反应、相互作用等。该指南重点强调综合治疗概念,强调生活方式干预与药物治疗相结合,药物应用时抗心衰治疗与其他状况治疗相结合,充分体现心衰的处理是一系统工程的新观念。这一观点同样适用于HFpEF治疗策略。
联合指南编撰委员会主席、美国西北大学心脏病学系主任CW. Yancy博士指出,“这部指南属于GDMT概念的第一批产品。这一概念旨在使专科医生和初级保健医生都能方便地决定个体患者的最佳治疗。”新指南的一个主要焦点是HFpEF的治疗,其目标是阻止或延缓病情进展。新指南指出,在得到进一步研究结果之前,HFpEF的最佳治疗方式仍是整体治疗。“大约90%的HFpEF患者伴有高血压、冠心病、糖尿病、肾功能不全、心房颤动等合并症。在缺乏特异性治疗的情况下,针对这些合并症的治疗将使我们有机会改变疾病的自然史。”
结语
虽然目前尚无足够临床研究证据证实存在针对HFpEF有效的特异治疗方法和药物,但研究已提供了一些有效干预的证据。鉴于心衰是一个由多种病因引起的临床综合征,故循证的HFpEF 治疗与个体化的治疗并不矛盾,临床实践中应坚持两者相结合。临床医生应在最新指南指导下,依据现有临床研究证据,针对患者具体情况,实施最优个体化治疗,重在控制基础病因与合并症,以期改变病情发展,改善患者预后。
[下一页] [1] [2]