马长生 陈英伟 首都医科大学附属北京安贞医院
规律的体育锻炼作为心血管疾病一级或二级预防的有效手段,能显著提高生活质量,改善预后。然而,在合并隐匿性心血管疾病的个体中,高强度运动可能促发心脏性猝死(SCD)。运动员猝死事件也给运动员群体带来恐慌,使人们对参加体育运动产生一定程度的顾虑。SCD在不同类型运动间也存在差异,在美国,从事篮球和橄榄球的运动员SCD发生率最高,而在欧洲,足球运动员SCD风险最大。
SCD发病的已知与未知
运动员SCD发病与年龄相关,年龄大于35岁运动员中,80%的SCD是由动脉粥样硬化引起。而小于35岁发生SCD的运动员中,遗传和其它获得性心血管异常占主要因素,其中,包括肥厚型心肌病(HCM)和致心律失常性右室心肌病(ARVC)在内的心肌病是首要原因(图1)。
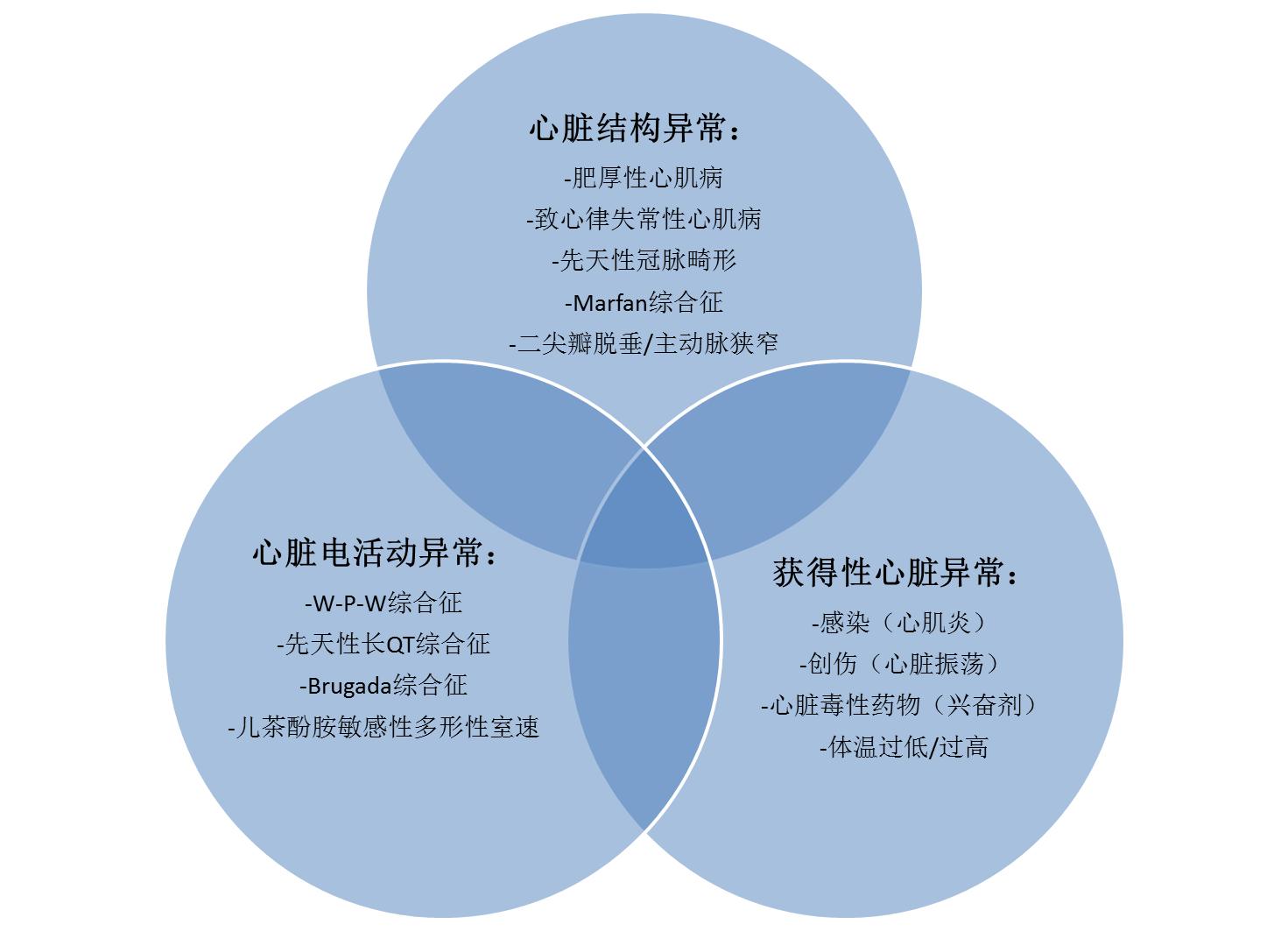
图1. 导致年轻运动员SCD的常见原因心脏结构异常
心脏结构异常与运动员SCD
HCM的发生率为0.2%,运动员中为0.07%~0.08%。HCM为常染色体显性遗传性心脏病,临床表现以左心室肥厚为特征。运动增加HCM患者发生SCD风险,HCM是美国年轻运动员赛场猝死最常见原因。HCM所致的SCD常发生于橄榄球、篮球运动,很少发生于划船、长距自行车、跑步等耐力性运动。原因可能与HCM患者更倾向选择非耐力性运动有关(HCM患者往往合并心脏舒张功能受损、心肌缺血、左心室流出道梗阻,限制了长时间心搏量输出)。HCM诊断主要依赖于心电图(ECG)和超声心动图(UCG)检查。90% HCM患者的静息ECG存在异常(图2A、2C)。有心脏停搏及持续性室性心动过速(VT)的高危SCD的HCM患者都需置入ICD。
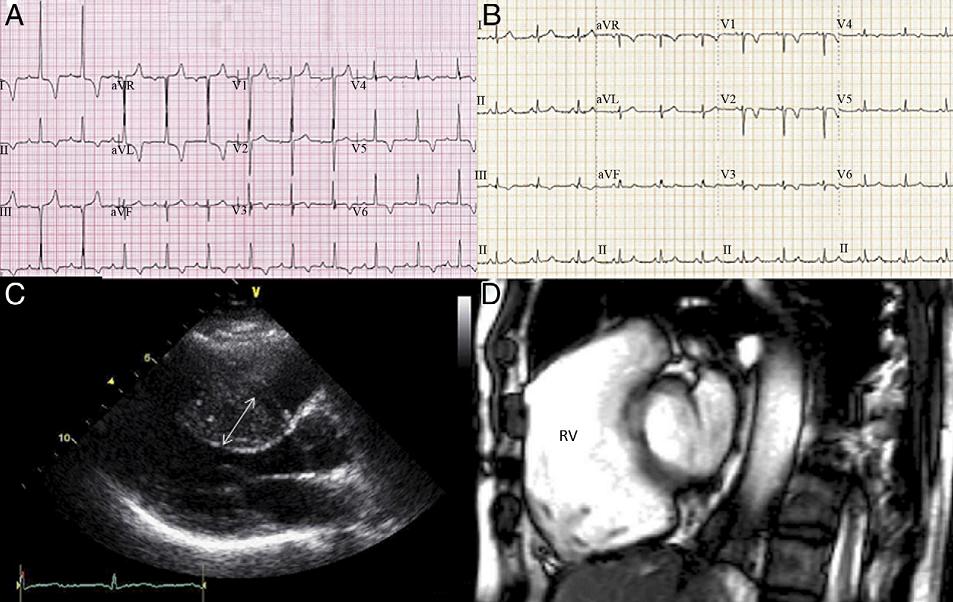
图2. HCM和ARVC患者ECG及影像学异常表现(A:HCM患者ECG提示心电轴左偏,增高的电压符合左心房扩大和左心室肥厚诊断标准;B:ARVC患者ECG提示右胸导联T波倒置;C:经胸心脏超声提示HCM患者室间隔显著非对称增厚,箭头所示厚度为22 mm;D:心脏MRI提示ARVC患者右心室扩张,室壁纤维化。)
ARVC ARVC为一种常染色体显性遗传性疾病,一般人群发病率1/1000。竞技性运动导致ARVC患者SCD发生率增加5倍,意大利一项研究报道25%的运动员猝死为ARVC所致。ARVC导致猝死机制较复杂,可能与运动致右心室急性扩张,心肌细胞延伸,细胞分离,从而导致室性心律失常及猝死。对SCD幸存者研究发现,局部心肌炎症及随后愈合导致心肌细胞被脂肪组织进展性替代,形成VT/心室颤动(VF)的基质。ARVC诊断依赖于2010年制订的标准,包括症状、家族史、静息/运动ECG变化,UCG和心脏MRI及心肌组织定性检查(图2B、2C)。
先天性冠状动脉畸形(CCAA) CCAA造成了12%~33%的运动员猝死。最常见冠状动脉畸形为左冠状动脉起源于右冠窦,或右冠状动脉起源于左冠窦。运动导致SCD机制可能为起源走行异常的冠状动脉受压或痉挛影响血液供应,造成心肌内皮功能紊乱,心肌缺血,诱发室性心律失常。CCAA导致的SCD幸存者先前常无症状。诊断:ECG、UCG和运动试验检查很难发现CCAA。心脏MRA和冠状动脉CTA是诊断CCAA金标准。治疗上首先推荐外科矫正。对于无症状运动员,哪些类型的AACC需外科治疗还存争议。
其它心脏结构异常 其它与SCD有关的心脏结构异常主要包括主动脉夹层(大多由Marfan综合征引起)、二尖瓣脱垂及主动脉瓣狭窄。①Marfan综合征为一种常染色体显性遗传性疾病。发生率1/5000。3%的年轻运动员运动相关SCD与之相关。其机制为运动造成主动脉压力升高,使已存在中膜囊性坏死的主动脉破裂,导致猝死。②二尖瓣脱垂普通人群发病率3%~5%,二尖瓣脱垂发生SCD的报道较少,目前报道只有不到100例患者单纯存在二尖瓣脱垂,其中仅3例猝死与运动有关。猝死与室性心律失常有关,确切机制不详。③主动脉瓣狭窄中主动脉瓣二叶畸形有关的主动脉瓣狭窄较少见,但目前认为该结构异常可造成年轻运动员猝死。
心脏电活动异常与运动员SCD
W-P-W综合征 W-P-W综合征常导致房室折返性心动过速。一般人群与运动员群体W-P-W发生率相近(0.1%~0.3%)。心电图检查可有特征性表现:δ波、短PR间期、宽QRS。W-P-W患者发生SCD的原因与合并心房颤动时快速心房激动通过旁道引起快速性室性激动有关。
先天性长QT综合征(LQTS) LQTS为一组涉及不同离子通道疾病的疾病。一般人群发生率1/(2000~5000)。美国一项注册研究报道,2%的运动员SCD与LQTS有关。LQTS患者心肌复极存在异常,易导致多形性VT/VF。LQT1常与运动时SCD有关,尤其在游泳、跳水时(突然侵入冷水中导致儿茶酚胺分泌显著波动,促使心律失常发生)。在不应用引起QT延长药物情况下,男性QTc超过440 ms,女性超过460 ms时应考虑LQTS。与一般人群相比,运动员QT间期可轻度延长,0.4%~0.7%高强度训练的运动员QT间期可能>440~460 ms。LQTS引起SCD的高危风险包括QTc间期>500 ms、青少年、或LQT2基因型的女性。对有SCD病史、反复性晕厥、包括β受体阻滞剂在内的药物治疗后仍发作多形性VT的患者,建议置入ICD。
Brugada综合征(BrS) BrS为钠离子通道基因突变的常染色体显性遗传性疾病。发生率1/(2000~5000)。ECG特征包括不完全右束支阻滞,右胸导联ST段抬高(1型BrS)。BrS与运动性SCD无典型相关性,而长时间运动后休息时迷走神经张力增加及运动导致体温显著升高可触发室性心律失常,增加SCD风险。
儿茶酚胺敏感性多形性VT(CPVT) CPVT引起的SCD与运动或情绪激动促发的儿茶酚胺介导的多形性VT有关,多发生于有青少年猝死家族史及压力导致晕厥史的个体。
获得性心脏结构异常的问题
心脏振荡 胸部钝挫伤在不造成胸廓或心脏直接创伤情况下可触发VF和SCD。心脏振荡主要发生于从事冰球、曲棍球、棒球等抛掷运动的运动员。儿童及青少年发生心脏振荡的报道较多,与胸廓薄瘦允许较大冲击力传导至心脏有关。动物实验报道,在实验动物心电图T波波峰前10~30 ms心前区单一撞击可诱发VF。机制可能为:左心室压力迅速升高,通过机械-电偶联产生内向电流延长复极时间,导致心肌不均一激动,触发VT和SCD。
心肌炎 7%的运动员猝死由病毒感染性心肌炎引起。对近期有病毒感染史,新出现心衰体征,运动不耐受,ECG提示复极异常和/或UCG检查区域性室壁搏动异常的年轻个体,需考虑病毒性心肌炎。心肌炎导致SCD机制可能与引起扩张性心肌病,心功能不全,诱发室性心律失常有关。确诊有心肌炎的运动员需限制运动6个月,以降低SCD风险。
服用兴奋剂类药物 合成代谢男性激素类固醇、麻黄碱、促红细胞生成素等能够提高运动成绩的药物都有引起SCD风险。合成代谢男性激素类固醇能改变脂代谢,导致过早动脉粥样硬化和心肌梗死发生。麻黄碱能导致心肌病和室性心律失常。因此,运动员发生SCD后建议行毒理学检测。
早发冠心病 意大利和美国一些研究报道,早发冠心病占年轻运动员猝死病因的2%~3%。
运动前健康评估及诊断中的困难
2005年欧洲心脏病学学会(ESC)公布了年轻竞技性运动员预防SCD的心血管筛查共识,美国心脏协会(AHA)也于2007年发表了竞技性运动员心血管异常筛查建议。但该项工作的瓶颈在于缺乏经高度专业培训的医生进行评估工作,以及在不影响运动员训练和比赛情况下组织更深入的调查。评估运动员SCD可能风险流程,如图3所示。
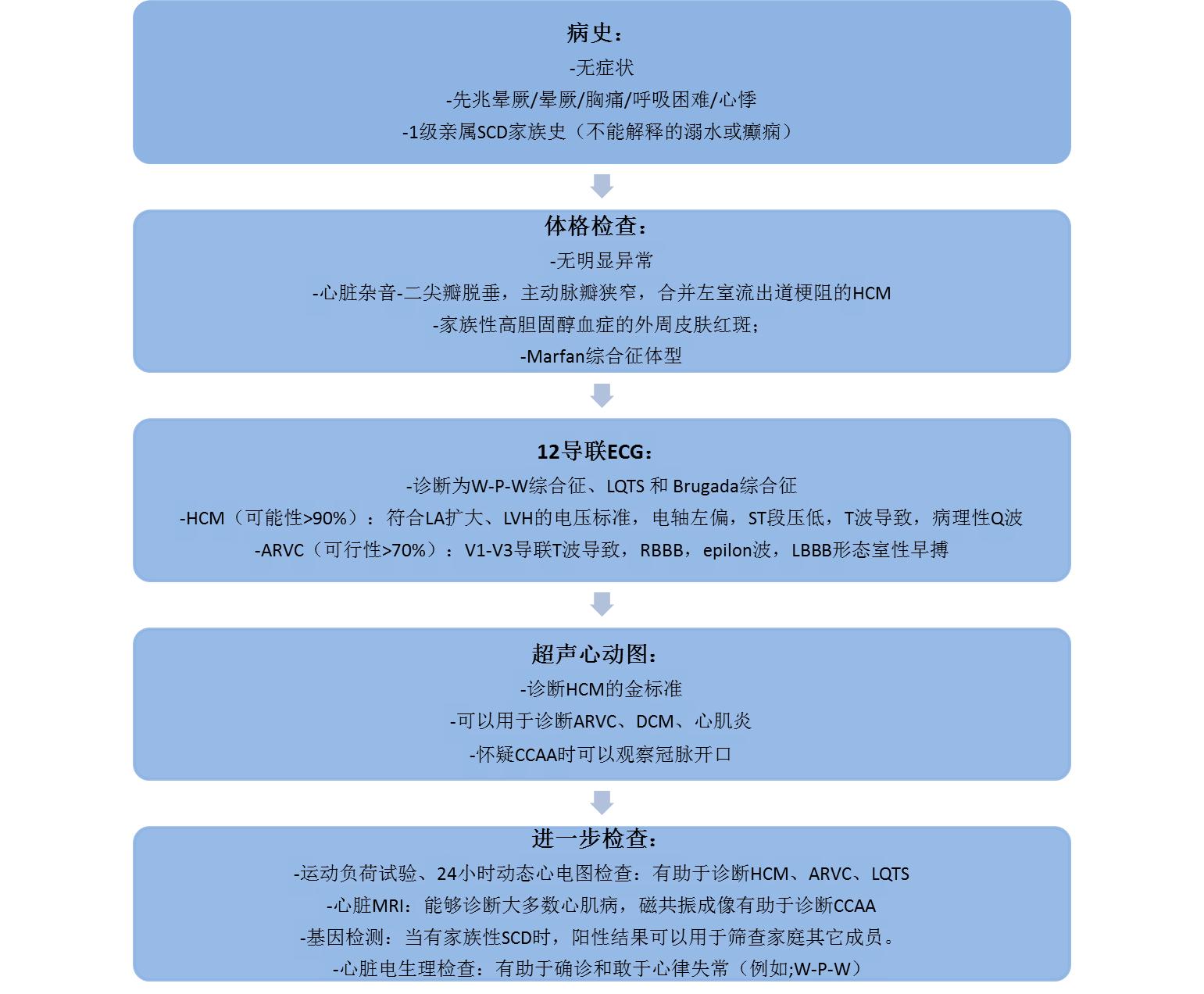
图3. 评估运动员SCD可能风险流程
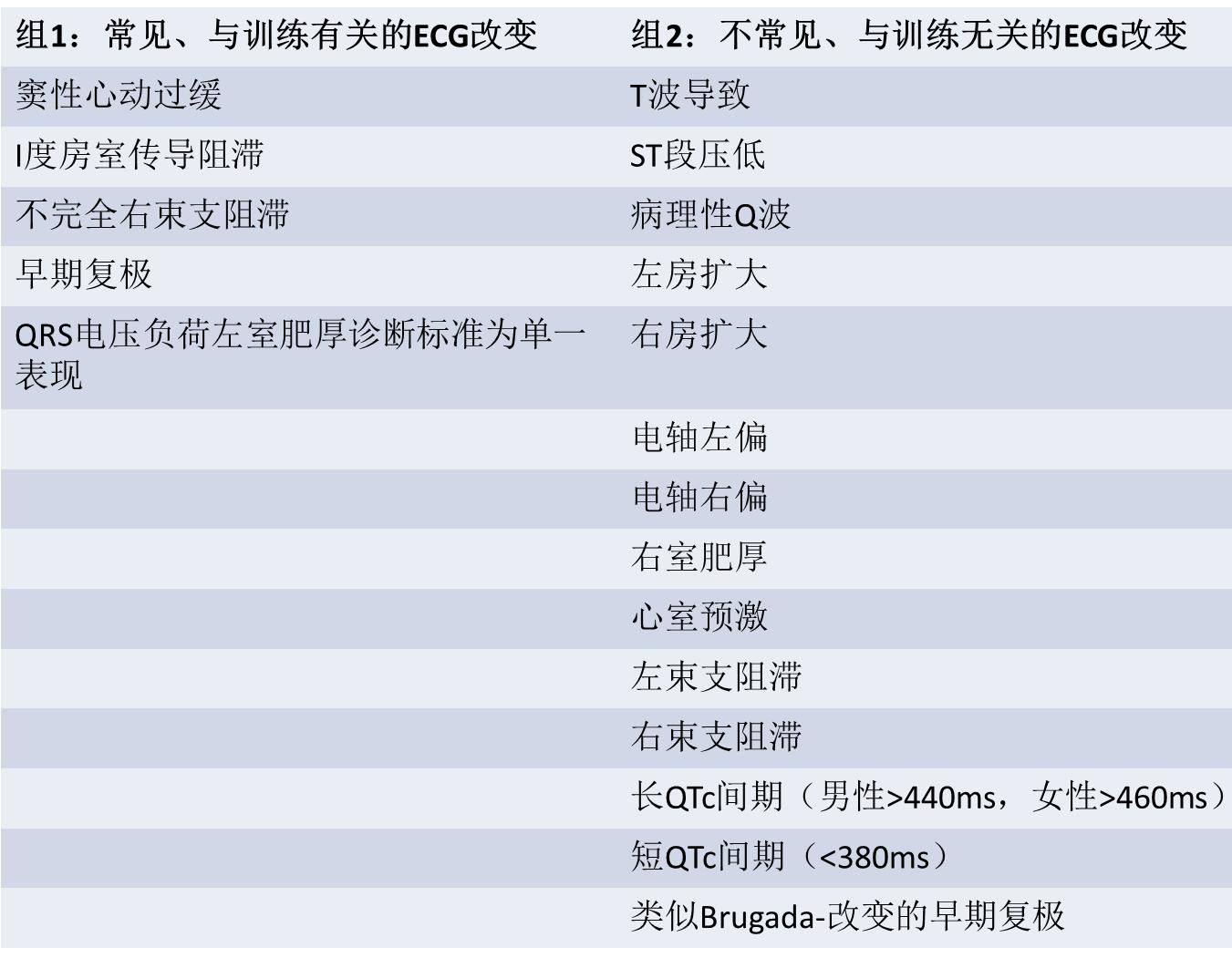
规律运动可引起心脏结构、功能的适应性改变,包括左心室厚度增加及心室腔扩大,这种适应性改变能增加左心室舒张期充盈及每搏输出量,从而在快速心率情况下产生大而持久的心脏输出,即为运动员心脏,这种改变可能反映到ECG或UCG检查相应参数上。正确区分心脏的生理学改变和病理性异常十分重要,因为假阳性诊断会错误的取消运动员运动资格,进而影响运动员收入及增加心理压力。然而假阴性诊断可能会导致SCD风险。但通过ECG或UCG检查区分心脏适应性结构改变及本身存在的病理性结构异常往往很困难。为了尽可能鉴别这两种情况,ESC已针对性的制订出用于解释运动员ECG的标准,该标准在高加索运动员筛查中降低假阳性诊断。如表1所示:ECG的第1组改变由心脏适应性改变引起,存在于80%的运动员;第2组表现仅存在于5%的运动员,该类型改变往往提示存在心血管疾病,最常见于心肌病和离子通道疾病。当运动员ECG出现第2组改变时,建议进一步检查。
表1. ESC制订的运动员12导联ECG异常标准分类
运动员心脏和HCM 在从事耐力运动的男性运动员中,很大部分左心室室壁厚度适应性增厚至13~15 mm。而大多数HCM患者左心室室壁厚度为18~20 mm,不到8%的HCM患者室壁表现为轻度增厚。因此,左心室室壁厚度为13~15 mm的男性运动员需鉴别左心室肥厚为生理性适应改变或病理性异常。研究表明,在2%~4%的白人运动员和12%~18%的黑人运动员中鉴别困难(图4)。对于大多数运动员,ECG和UCG检查能明确诊断。相当多运动员ECG检查发现QRS电压增高幅度符合左心室肥厚诊断标准,但仅2%的HCM患者达该标准。支持HCM诊断的ECG改变包括:T波倒置、病理性Q波、连续2个以上导联ST段压低和左束支阻滞。生理性改变为左心室均匀肥厚,而HCM患者心室肥厚往往不对称,室腔较小,左心室舒张功能不全。左心室舒张末期内径>55 mm在经过训练的运动员中很常见,但在HCM患者中常<45 mm。此外,HCM患者心脏组织多普勒可发现左心室室壁舒张和室腔充盈受损。在一些运动员,心脏MRI检查有助于发现前游离壁、后间隔和心尖部节段性左心室肥厚。在鉴别困难的患者,HCM和SCD家族史、运动心肺功能检查低峰值耗氧量更倾向于HCM诊断。
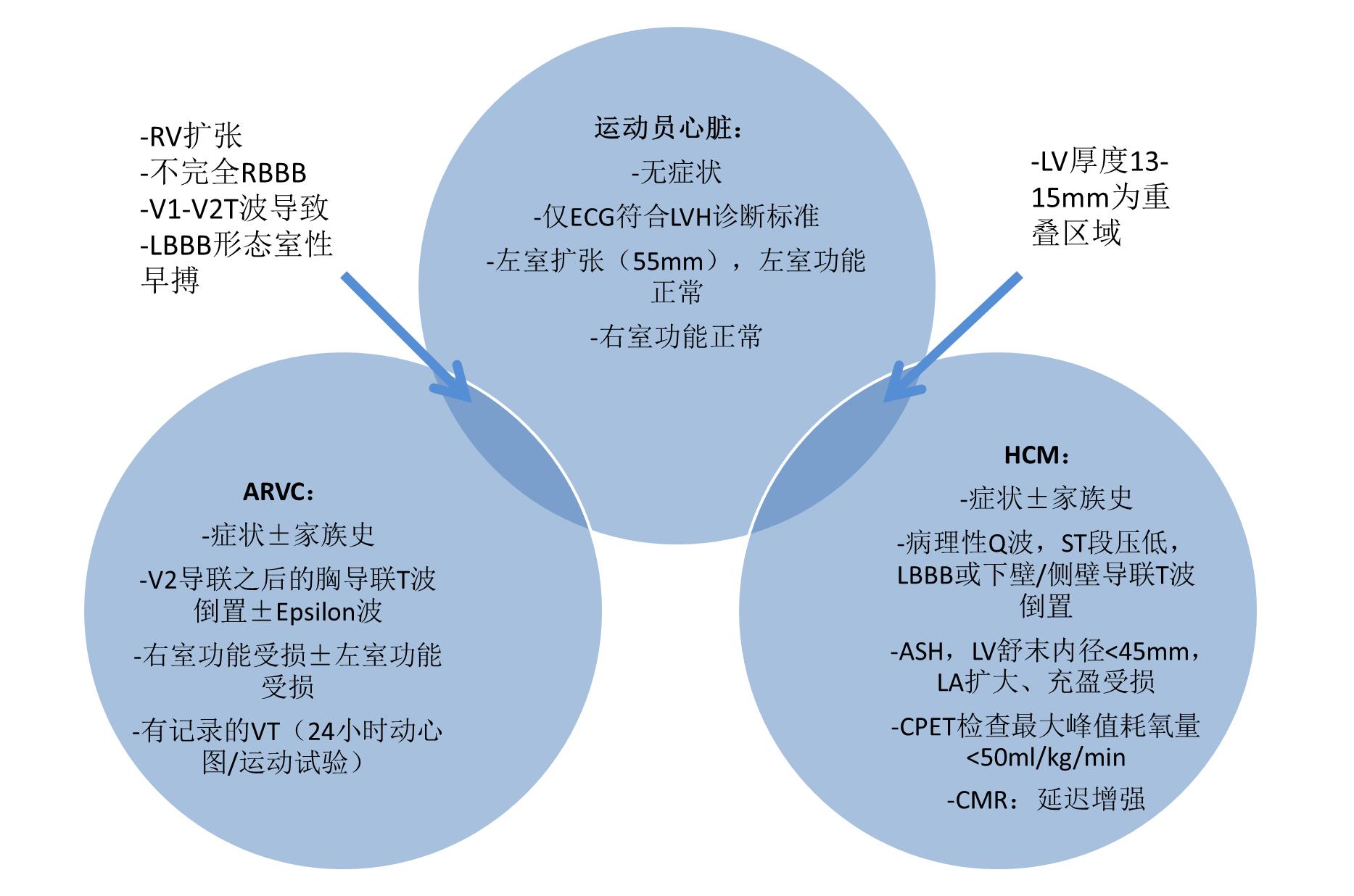
图4:规律体育锻炼所致心脏结构和功能的适应性改变(运动员心脏)与HCM和ARVC存在交叉,一些典型特征可用于鉴别生理性改变和病理性异常。
运动员心脏和ARVC 在运动员中筛查出ARVC较困难,早期往往隐匿发展,心脏形态学表现正常。ECG检查可发现右胸导联轻度异常、偶发右心室早搏,这些轻度异常可能会被右心室适应性改变所掩盖。Epsilon波、信号平均心电图异常晚电位、左束支阻滞形态的非持续性VT、局部右心室室壁运动异常支持ARVC诊断。
运动员的QTc间期 先天性LQTS诊断基于以下3点:QTc间期延长、无征兆性晕厥和有记录的多形性VT、SCD或LQTS家族史。普通人群中LQTS发生率为1/(2500~10000),运动员中QTc间期延长比例报道为0.4%~0.7%。研究表明,2%~4%的年轻运动员SCD与离子通道疾病有关。运动员中长QTc间期发生率高而LQTS导致SCD比例低的矛盾现象提示,大多数运动员的QTc延长是良性的。运动员中孤立QTc间期延长可能是左心室增大、复极时间延长所致。
黑人运动员 研究表明,与白人相比,黑人ECG复极改变更显著,左心室肥厚程度更明显。可推测运动相关心脏前后负荷增加对心脏重塑影响在黑人运动员中表现更明显,因此,对黑人运动员尤其需鉴别左心室肥厚是由于心脏适应性改变还是病理性异常。
合并早期复极的运动员 运动员中早期复极比例为22%~43%,这种改变在心率慢、训练更持久的男性黑人运动员更普遍。尽管迄今只有一项研究提示运动员ECG下壁/下侧壁ST段水平/下斜型压低的复极改变与心脏停搏有关,大多数证据表明,运动员出现早期复极是良性的。目前,就早期复极来说,没有证据支持其在推荐运动员是否能从事竞争性运动的评估中有价值。
本刊评论:运动也是一把双刃剑
运动和体育锻炼可以增强体质,同时也能引起猝死,涂炭无辜的生命。优秀运动员常凭借身体素质的天赋,凭借过人的毅力,经过有素的训练、顽强的拼搏而在比赛中一举成名,成为公众心目中的英雄和偶像,甚至成为民族英雄、国家的骄傲,但竞技场上也不时会传来噩耗。
欧洲Veneto地区对年轻运动员(12~35岁)和非运动员24年随访的结果表明,该地区每年运动性猝死率高于美国,男性为2.6/10万,女性为1/10万,剧烈运动或运动后即刻猝死的风险能增加 5~20倍。 来自意大利的一项区域性注册研究提示,运动员猝死发生率为3.6/10(万人o年),美国的一项研究报道,运动员SCD发生率为2.3~4.4/10(万人o年)。美国包括连猝死发生率相对较低的青年运动员每年猝死近300人。美国明尼苏达州调查了12年内参与27项运动的140万非职业运动员的学生,其中高中生运动性猝死的发生率为1/10万(男)和1/30万(女),大学生运动性猝死的发生率增加到1/6.5万。成年运动员的猝死发生率更高,马拉松运动员每年猝死发生率为1/5万。男性运动员发生SCD风险为女性的5倍,SCD性别差异的原因可能与女性心血管异常发生率较低有关。调查显示,美籍加勒比黑人从事竞技性运动的运动员SCD发生率为5.6/10(万人o年),高于其它人种运动员,原因可能与患肥厚性心肌病(HCM)的黑人运动员猝死风险更高有关(黑人运动员为20%,白人为10%)。
不断探索运动前心血管筛查的最佳方案
现代医学对猝死高危者的检出、危险分层及预警作用仍很局限。流行病学的资料表明,对猝死人群回顾性评价医学在其生前能予诊断与预警作用时证实,现代医学能够识别和预警其为猝死高危者仅占1/3,而生前诊断为猝死中危或低危者占1/3,而另外1/3的猝死者生前毫无蛛丝马迹,被医学认定是无猝死危险的健康人,而猝死成为他们的首发症状,很多运动性猝死者则属于后1/3人群。
如何在具有潜在心血管疾病的竞技型运动中在生前得以诊断?筛查运动员个人和家族史、体格检查、ECG和超声心动图检查可以确诊大部分患者。然而这种例行筛查不太切合实际。例如,筛查个人史和体格检查可以发现诸如高血压、主动脉瓣狭窄等明显的心血管疾病,但对其他疾病的敏感性较低,例如大部分猝死的肥厚型心肌病生前并无响亮的心脏杂音或即使表现为非梗阻型伴异常心电图。
把ECG纳入到运动前心血管筛查筛查能够提高可能导致SCD疾病的检出率。对于W-P-W综合征以及包括LQTS和BrS在内的离子通道疾病,ECG检查可以作为诊断的金标准。此外,ECG识别心肌病的能力也比较高,超过90%的HCM患者和超过75%的ARVC患者ECG可以有异常表现。在意大利,所有的运动员都需要强制性的运动前筛查,包括:12导联心电图、症状、家族史、体格检查等等。意大利的这一运动前筛查已经执行了25年,结果证明,这种筛查方案使SCD的发生率从3.6/10万人/年减少至0.4/10万人/年,死亡率下降了90%,SCD下降的原因归因于心肌病,特别是ARVC的发现。基于意大利经验,ESC在一项由国际奥委会牵头的报告中建议在运动员中常规开展进行包括心电图在内的运动前筛查工作。
尽管已经有强有力的证据表明将ECG纳入运动前筛查能够显著的降低运动员SCD的发生,但AHA目前并不支持把ECG作为常规检查项目,首要原因是基于ECG的假阳性发现、费用-效益比以及可能会增加运动员及其家庭的心理压力的考虑。猝死在竞技性运动中还属于少见现象,而且ECG并不能鉴别出所有与SCD有关的基础疾病,特别是目前大多数已经公布的运动员SCD数据来源于白人,并不适用于所有群体的运动员。将当前心电图异常标准应用于运动员中会造成4%-7%的假阳性诊断,这样会对运动员和运动医生影响很大。然而,由于大多数SCD存在于先前无明显症状及无显著心血管系统阳性发现的个体,因此将ECG纳入运动员筛查中还是有重要意义的。
早期识别心脏骤停与及时体外除颤和心肺复苏
早期识别出心脏骤停,及时体外自动除颤和心肺复苏能够显著的提高运动员的生存率。在运动场所建立紧急反应系统有助于改善SCD运动员的预后。最近,一项包括1710个配置有自动体外除颤装置的美国高校的研究发现,在经历SCD的36例患者中,23(64%)的成功存活,提示早期的除颤能够改善发生SCD的年轻运动员的预后。
SCD在运动员中发生率虽然较低,但后果严重。因此建议在竞技性运动员中开展常规运动员筛查工作,同时,增加运动场所自动除颤的配置及专业运动医务人员的培训,以进一步降低运动员SCD的发生,减少SCD事件对社会的不良影响。
重在预防和警笛长鸣
近年来,运动性猝死的发生率每年都有增加。被誉为"花蝴蝶"的乔伊娜是美国著名的短跑运动员,是奥运会100米、200米的金牌得主,他保持的女子百米记录至今无人能够问鼎。她身材优美、面容清秀,倾倒无数的"粉丝",1998年9月21日,乔伊娜的猝死震撼了国际体坛。人们也永远不会忘记2003年6月26日,喀麦隆国家足球队与哥伦比亚队进行半决赛的第72分钟,国脚维维安o福猝死在赛场,猝死时他痛苦面容和躯体挣扎时的楚痛永远留给了世界。桩桩惨死让人哀痛,幕幕悲剧令人清醒,减少运动性猝死的有效办法就是重在预防,警笛长鸣。
对健康做定期评估虽然很难人人兑现,但预防猝死却十分有效,其包括详细询问个人史、家族史、记录12导联心电图、超声心动图等检查,最后做出健康评估的结论。对于中学和大学生参加竞技性运动时,训练开始前应进行心血管疾病的筛查及健康评估。意大利Veneto地区针对运动员猝死进行了长期、系统性预防并取得令世人瞩目的成功经验,其坚持在病史和体检的基础上,依据12导心电图为运动员定期检查已达24年。结果证明,这种筛查方案能有效发现和检出在此之前未能被诊断的肥厚型心肌病,以及有明显心律失常的运动员,这种筛查使运动性猝死率下降89%。 此外,提高运动场所安全性设备水平也十分重要,称公众体外自动除颤器(AED)应当像消火栓一样装备在运动场所,运动性猝死一旦发生则可及时应用,进而提高复苏抢救的成功率。
(编辑 孙煜)
[下一页] [1] [2] [3] [4] [5] [6]