李悦 刘磊 哈尔滨医科大学附属第一临床医院
正方观点:CMR已成为心血管病诊断技术中的生力军
作为影像医学发展前沿之一的磁共振成像(Magnetic Resonance Imaging,MRI)以其无创、无辐射、不使用含碘对比剂、可任意层面扫描、高软组织分辨力和三维立体成像等特点在心血管领域应用愈加广泛。近年心血管核磁共振(Cardiovascular Magnetic Resonance,CMR)技术发展迅速,已经由传统形态学评价模式过渡到形态、功能相结合的综合评价模式。能够同时完成心脏和瓣膜形态、运动功能,心肌灌注及活性、室壁运动的评估。磁共振血管造影(Magnetic Resonance Angiography,MRA)能够对血管解剖形态和功能进行评价。
冠心病诊断方面的优势
冠状动脉造影和多层螺旋CT血管成像(MDCTA)是诊断冠心病的常用方法,检查时患者需暴露于射线下,并使用含碘对比剂,易发生放射性损伤、对比剂肾病等严重并发症。冠状动脉MRA无电离辐射和含碘对比剂使用,并在诊断中-重度钙化斑块方面优于MDCTA,可显示钙化部位管腔内部,识别无症状心肌缺血(图1)。
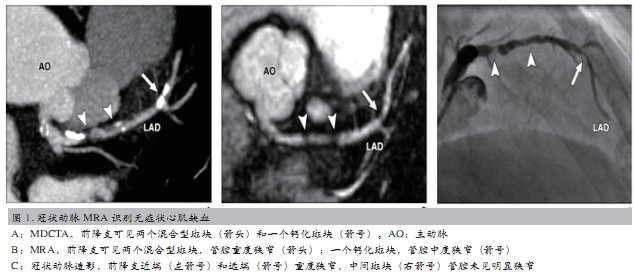
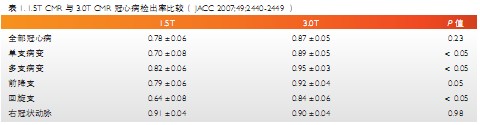
CMR首过心肌灌注成像结合潘生丁或多巴酚丁胺负荷试验是判定心肌缺血的有效方法。正常心肌灌注成像表现为从心内膜到心外膜信号逐渐增强,幅度均匀一致。缺血心肌灌注异常表现为:①静息状态灌注正常,负荷状态心内膜下或透壁性灌注减低或缺损;②静息状态灌注减低或延迟、负荷状态灌注缺损;③静息状态灌注缺损。新进研究提示,与1.5T CMR相比3.0T CMR能够进一步提高冠心病的检出率,对单支或多支病变均有更高的敏感性和特异性(表1)。
梗死区心肌CMR表现为:①收缩期室壁增厚率减低或增厚消失,收缩功能低下,运动不协调或无运动;②首过灌注可见灌注减低、缺损;③延迟期由于心肌缺血坏死,细胞膜破坏,对比剂进入细胞内,比正常心肌排出延迟,表现延迟增强。延迟增强是反映心肌坏死的重要标志。根据延迟增强范围可鉴别心内膜下心肌梗死和透壁性心肌梗死。CMR还可鉴别急性与慢性心肌梗死。
判断存活心肌为心脏血运重建提供重要依据,对血运重建术预后作出判断。负荷超声心动图根据给药前后室壁运动变化判断心肌存活情况,不能直接检测心肌灌注情况和梗死透壁程度。CMR是检测存活心肌的有效工具,能检测心肌灌注情况和细胞膜完整性,延迟增强可作为检测无功能恢复或非存活心肌的有力证据。小剂量多巴酚丁胺可使正常和存活心肌心室壁收缩期增厚率增加,而坏死及纤维性心肌则不增加,结合cine MRI评价心肌活性效果更佳,具有定量标准。Na代谢成像通过判断心肌梗死时电解质变化,确认心肌瘢痕组织并测量梗死面积。31P-磁共振波谱、微血管阻塞CMR和CMR标记技术等也对判断心肌活性有一定临床意义。
心力衰竭
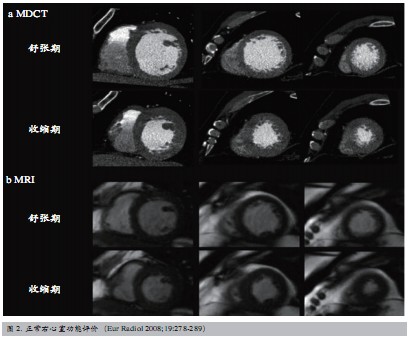
CMR常规扫描结合电影MRI(cine MRI)可直接显示心室大小和室壁形态学改变,计算射血分数、心室舒张/收缩末期容积、心搏量、心输出量、心脏指数和心室节段室壁增厚率等各种心脏功能参数,定量分析心室容积和心肌质量。结合静脉注入多巴酚丁胺负荷试验可检测心肌收缩功能储备。相位对比磁共振通过测量血液相位位移鉴别流动血液与静态组织,能够测量血流量和心输出量,评价心肌运动速度,有效评估心脏功能。近年右心功能评价逐渐引起重视。磁共振技术可清楚显示右心室心肌,精确测量右心室收缩和舒张末期容积、每搏输出量、射血分数及右心室质量,准确评估右心功能(图2)。
心肌炎和心肌病
心肌活检可见心肌细胞损伤伴淋巴细胞浸润,且无心肌缺血,是诊断心肌炎的重要标准之一。该标准特异性强,但敏感度低。新近研究提示磁共振技术在心肌炎诊断领域有重要价值。心肌炎患者心肌首过灌注正常伴延迟增强可与心肌梗死鉴别。CMR指导下心肌活检可大大提高心肌炎诊断敏感度。CMR对于鉴别心肌炎病毒类型和判断预后也有一定作用。
CMR的高分辨力特性可以确定心室腔的大小和结构,动态观察心室形状和容积、室壁运动和心室收缩功能、组织构成及灌注情况,有助于多种心肌病的诊断,对治疗效果及预后判断均有重要价值(图3)。CMR在Tako-tsubo心肌病和缺血性心脏病鉴别方面也有其优势。Tako-tsubo心肌病患者磁共振检查可见心尖区水肿伴收缩功能减低,水肿区无血管,并且无首过灌注缺损和延迟增强等表现。心肌梗死患者磁共振除表现为首过灌注缺损和延迟增强,还有左心室透壁性水肿,水肿区有血管分布。
磁共振技术能够任意方位、多层面成像,全面显示心血管解剖结构、空间位置及连接关系。不仅能够克服超声诊断的操作者依赖性,还能够对心血管造影无法克服的心内结构重叠等细节进行补充。利用“黑血”及“亮血”技术无需对比剂即可显示心腔及大血管形态和血流动力学变化。根据心脏位置、内脏-心房位置关系、心房-心室连接及心室大血管连接进行分析,有助于复杂畸形诊断。肺静脉异位引流患者肺静脉位于左心房后方,表面覆盖肺组织和支气管结构,超声心动图难以准确评价,而心导管检查对紫绀型先天性心脏病患者有较大风险。CMR可清晰显示肺静脉连接关系,对完全型肺静脉异位引流诊断准确率高达100%。CMR用于婴幼儿及胎儿心脏检查,可大大提高先天性心脏病诊断率。由于CMR没有电离辐射,《心血管磁共振专家共识》委员会认为,对于小儿先心病患者只要有断层影像检查的指征,且有专业人员进行操作分析时,可优先使用CMR检查。

心脏瓣膜病
CMR可显示瓣膜形状、厚度、有无赘生物等。通过cine MRI能够显示瓣膜运动情况和开放、关闭程度。瓣膜狭窄时可见心脏收缩期由于血流快速通过瓣膜形成的信号丢失;瓣膜关闭不全时可见心脏舒张期血液反流造成的信号丢失。相位对比磁共振可通过测量血流速度及返流程度,计算跨瓣压差。CMR还能显示继发于瓣膜病的心脏结构改变。
主动脉、肺动脉疾病
主动脉疾病主要包括主动脉夹层、壁间血肿、主动脉瘤和先天性主动脉及其分支畸形等。CMR除可显示病变部位、性质、结构和累及范围等,还可通过相位对比磁共振进行血流监测,正确及时治疗提供形态学和功能信息。磁共振技术对肺动脉栓塞及肺动脉高压诊断有很高价值。肺动脉栓塞血栓栓子在T1WI为等信号,T2WI为高信号。肺动脉MRA可显示肺动脉树,栓子表现为血管内充盈缺损。磁共振肺灌注成像显示栓塞血管供血区肺组织楔形灌注缺损,时间-信号强度曲线低平,峰值消失。肺动脉高压CMR表现为右心室增大、主肺动脉干、左右肺动脉管腔扩大。肺动脉MRA可见中心肺动脉扩张,远端分支减少、纤细。磁共振肺灌注成像见两肺灌注延迟、灌注峰值减低、达峰时间后移和峰值时间延长等。
其他方面的应用
MRI还可用于心肌干细胞移植在体示踪,利用磁性对比剂标记干细胞,对其精确定位,观察移植细胞的迁徙、分化。目前常用对比剂包括产生T1正性对比效应的钆(Gd3+)对比剂和产生较强T2负性对比效应的氧化铁对比剂。氧化铁对比剂能被干细胞吞噬,可用于追踪探测移植的微量干细胞。磁共振荧光透视还能够引导干细胞精确移植,集治疗与监测于一体。
CMR还可用于心脏肿瘤疾病的诊断。CMR可精确显示肿瘤与心血管结构之间的关系,清晰描绘心脏内肿物的位置、大小和范围,通过分析T1、T2不同信号强度,对病变性质作出判断并可观察其向外浸润的情况。CMR心血池信号流空有助于识别心内肿瘤。
反方观点:无法突破瓶颈,CMR何以登堂入室
3.0T MRI在心脏成像方面的进展并不显著
2002年,美国FDA批准了3.0T MRI的临床应用许可,与以往MRI相比,3.0T MRI在心血管疾病检查方面具有更多的临床应用优势,尤其在MRA方面。3.0T可以显著加快质子自旋极化速度,成倍增加信噪比,而应用钆对比剂后图像对比度也获得更大的提高。然而,3.0T MRI在心脏成像方面的进展并不显著,由于射频脉冲不均一性的增加,图像更易出现磁敏感效应伪影,这种伪影是由于相邻结构的磁化率不同所致,尤其存在于空气-组织界面、组织-骨骼界面等磁化率相差较大的区域,可以引起局部磁场畸变,导致信号损失或错误描绘而致伪影。cine MRI经常可发现临近肺或膈肌等结构的心肌存在大片的信号缺失。目前尚无有效的方法消除这种伪影,现已成为限制CMR在3.0T发展的瓶颈之一。
未能精确显示斑块成分,对评价斑块稳定性价值有限
全心冠状动脉MRA可通过一次扫描同时完成3支冠状动脉成像,相位对比结合cine MRI可测量冠状动脉血流速度及血流储备。冠状动脉MRA还可用于观察桥血管是否通畅。由于冠状动脉管径小、位置深、走行迂曲、受呼吸和心脏运动影响,CMR冠状动脉成像时需要应用心电门控减轻心脏搏动伪影,应用屏气或导航技术控制呼吸伪影,需要应用脂肪抑制技术提高冠状动脉显示清晰度。3.0T MRI扫描在自由呼吸状态下由导航回波触发扫描,获得全心图像,经过重建得到冠状动脉图像。这种扫描方式较以往屏气法扫描更易耐受,准确性也更高。但导航效率偏低使检查时间过长是这一技术存在的主要问题。此外,目前应用最多的膈肌导航,由于膈肌的运动与冠状动脉不完全一致,其导航的准确性有限,有时会造成扫描失败。CMR可根据斑块组织成分不同T1、T2值,在T1加权像(T1WI)和T2加权像(T2WI)表现的信号差异来分析斑块形态及病理成分。但受空间分辨率和成像序列限制,CMR不能精确显示斑块成分,对评价斑块稳定性价值有限。
CMR临床应用的安全性问题
CMR临床应用安全性日益受到重视。《心血管磁共振专家共识》指出CMR应用需注意的安全问题包括:扫描室内金属物体飞射;对体内心血管置入设备的影响;对比剂相关问题。在CMR扫描过程中,外来磁性物体进入扫描室存在被吸入磁体的危险,此过程可能伤及室内的人员。体内置入设备安全性分为安全、条件性安全和不安全三个等级。CMR扫描仪的静磁场强大,非磁性的冠状动脉支架进行CMR检查通常是安全的,但不建议在3.0T场强下扫描。磁性物体可能会发生移位,但固定良好的弱磁性物体置入物一般不会产生移位,如人工瓣膜,其受到心脏搏动及血流冲击的力量,远大于CMR对其的作用力。进行CMR扫描时,梯度磁场的快速切换,会在金属线或导丝中产生电流,导致心律失常的发生。除磁场因素外,射频脉冲被人体吸收后,会导致患者体温升高,同时也使得置入物发热,多发生于心脏起搏器和埋藏式心律转复除颤器。心脏起搏器和主动脉球囊反搏器含有复杂的电磁元件,射频脉冲可能干扰其功能,不建议进行CMR检查。
含钆对比剂是一种静脉内注射药物,临床常用的含钆对比剂主要有欧乃影(钆双胺)、马根维显(钆喷酸葡胺)和钆弗塞胺等。其不良反应发生率显著低于含碘对比剂,主要包括过敏反应、注射部位不适伴温热感或冷感、惊厥、味觉异常等。有文献报道肾功能不全患者使用钆对比剂后可出现一种罕见但极其严重的不良反应----肾源性系统性纤维化(Nephrogenic Systemic Fibrosis,NSF),其机制可能为肾功能不全患者体内钆对比剂清除时间延长,钆离子与配体复合物解离,游离的钆离子与体内磷酸盐、碳酸盐等阴离子结合,沉积于皮肤、肌肉、骨骼、肝脏和其他脏器。NSF的临床症状包括:早期出现四肢远端肿胀、表皮剥脱,皮肤进行性粗糙、增厚、硬化和紧缩,皮肤表面可见红色或黑色斑块,呈橘皮样,进而四肢僵硬、关节活动受限,全身多脏器受累、内脏纤维化,最终导致死亡。目前尚无有效的方法治疗NSF,因此,使用含钆对比剂之前应评估患者是否存在高NSF风险。NSF高危因素包括:急性肾损伤或慢性严重肾病(肾小球滤过率GFR<30mL/min/1.73m2)、严重的肝衰竭或肝移植、肾移植、血液高凝性、深静脉血栓以及外科手术所致软组织损伤,过量用药或反复使用含钆对比剂也会增加NSF的风险。美国放射学院对临床上使用钆对比剂提出了相应的指导意见:⑴ MRI增强扫描检查前应询问患者有无肾脏病史;⑵慢性肾脏疾病(Chronic Renal Disease,CKD)Ⅰ期和Ⅱ期的患者应避免使用欧乃影,可选用其他钆对比剂;⑶应明确告知CKDⅢ期患者存在发生NSF的潜在危险,尤其是对老年患者;⑷对所有CKDⅣ期、Ⅴ期或急性肾功能不全或正在进行透析的患者应评估其使用钆对比剂的利弊,尽可能避免对上述患者使用含钆对比剂。
[下一页] [1] [2] [3]