静脉桥血管病变的特点
在CABG术后1个月内发生的桥血管病变,多是由于血栓形成或技术操作原因引起,常表现为桥血管闭塞或吻合口狭窄,积极的介入治疗可以缓解患者的缺血症状。
CABG术后1~12个月出现缺血的原因通常为桥血管吻合口狭窄,静脉桥中段狭窄通常是内膜增生。这一时期的静脉桥血管病变多表现为孤立的局部病变或弥漫的退行性病变,多数孤立的局部病变可行介入治疗。桥血管远端吻合口狭窄对介入治疗反应较好,而桥血管与主动脉的近端吻合口狭窄常常存在致密的纤维组织,使再狭窄发生率增高。
CABG术后1年以上发生的缺血通常说明桥血管和/或原位冠状动脉出现了新的病变,且往往呈弥漫性。旁路移植血管粥样硬化斑块为易碎、富含脂质和血栓的粥样斑块,由于斑块松软且多伴有血栓,在介入操作中非常容易脱落,导致无复流现象、远端血管栓塞和心肌梗死。在桥血管PCI和原位冠状动脉PCI之间进行选择时,原则上应尽量行原位冠状动脉血管重建,同时结合罪犯血管部位、移植桥血管病变与原位冠脉病变的特点等综合判定。
桥血管病变的导引导管选择
RCA 静脉桥血管病变,如果开口水平,JR引导导管可作为首选;其次可以选择Multipurpose(MP)、AL引导导管;如果开口向下,一般选用MP引导导管,其次可以选择AL、JR和AR引导导管。起自于升主动脉的前降支和回旋支静脉桥血管可选择JR、MP、Hockey Stick(HS)、AL、AR引导导管 (图1)。

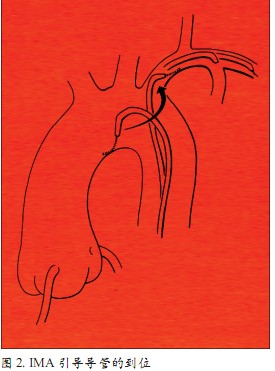
IMA桥血管一般选用乳内动脉或右冠状动脉引导导管。LAO60°可以使主动脉弓充分伸展,大血管暴露明显,利于引导导管引入左锁骨下动脉,然后再采用AP位使引导导管进入IMA(图2)。
应当指出的是:在桥血管PCI中,尽管有较多的引导导管可供选择,但往往找不到合适的,此时,术者应根据桥血管开口的形态自行对引导导管前端 “塑形” 。有时术者多次更换或调整引导导管,尖端仍难以到位,此时用超滑软导丝 “钓鱼”常能获得成功。当引导导管支撑差时,“钓鱼”、“双导丝”、 “微导管”深插等技术常有助于手术成功。因此,介入医生应具备丰富的导管经验和熟练的操作技巧。
目前经桡动脉途径介入治疗逐渐普及,已经有专用于经桡动脉途径桥血管介入治疗的引导导管。Kimny Runway引导导管可满足左、右冠脉以及静脉桥血管的治疗。其特点是具有特殊的弯曲(KIMNY 曲线),并增加了导管的硬度,所以具有较好的支撑力;新型的聚合物材质使导管塑性保持能力较好;导管头端增加的柔软度和不透线能力,使操控性更加出色。另一种经桡动脉途径专业导管为Radial Runway引导导管,其特殊的弯曲(Multivessel curve)设计,可以用于左、右冠脉及静脉桥血管的治疗。
血栓保护装置的应用
众所周知,静脉桥血管病变通常伴有较大、松脆的斑块,并且老的、退化严重的静脉桥血管内膜常有明显的散在血栓附着。因此介入方法干预桥血管病变常常伴有远端血管栓塞、无复流现象,严重者导致死亡。已有大量证据显示,在静脉桥血管的介入治疗中应用远端保护装置可减少远端栓塞改善患者预后。最早2002年Baim DS等人在《Circulation》上发表的SAFER多中心随机对照研究就显示,静脉桥血管介入治疗中使用GuardWire远端阻塞装置,可使30天MACE减少42%(16.5% vs. 9.6%,P=0.004),围手术期心肌梗死的发生率也明显降低(14.7% vs. 8.6%)。
除远端阻塞装置外,血栓保护装置还包括滤网系统和近端阻塞装置。其中滤网最为简单易学,临床应用也最广泛,其突出的优点是在操作过程中不阻断前向血流。SPIDER、FIRE以及PRIDE三项头对头的随机试验结果均显示,滤网远端保护器(FilterWireEX)效果并不亚于GuardWire。然而,在使用FilterWire时应严格掌握适应证,桥血管的参考直径应介于3.5~5.5厘米之间。由于FilterWire需置于距病变远端大于3厘米处,因此要求桥血管病变位置与远端吻合口距离应大于3厘米。在使用FilterWire时,应保证充分肝素化,使ACT>300s,或在应用GPIIb/IIIa的情况下使ACT>200s。定位时,应将FilterWire装置近端的标记点置于病变远端1.5~2厘米处,如在推送FilterWire装置过程中,遇到阻力或难以通过病变,可使用双导丝技术,或用球囊以低压预扩张病变。介入治疗结束后,回撤FilterWire装置时需轻柔,以免滤网内血栓脱落,同时整个回撤过程必须在透视下完成。
除技术层面外,对于CABG术后再次血运重建的患者,术前了解患者的临床情况并进行危险度分层是非常重要的。此人群往往合并多种高危因素,如高龄、合并其他疾病等。因此术前需要仔细分析患者手术的风险和获益,充分合理用药。术后还必须警惕围手术期出血、心肌梗死、对比剂致急性肾损伤等严重并发症。
(高霏整理 首都医科大学附属北京安贞医院)