正方观点:LVES优势更多,CRT登上新台阶
LVES的四大优势无法比拟
首先,经穿间隔等方式植入左室心内膜电极可以提供更多、更有效的起搏部位选择。CRT左室电极植入术中如果出现较高的夺获阈值,经冠状静脉分支植入方式则会受到解剖位置的限制,无法选择更为理想的位置。心室内膜电极植入方式可以轻松选择阈值更为理想的植入位置。心内膜植入方式也可以有效避免膈神经刺激。在心内膜植入可以应用主动固定电极,这样使左室电极的脱位率和右室电极一样低。
第二,左室电极中有嵌入式的心脏功能监测的传感器。电极植入左室腔内可以直接监测左室的收缩,可以更好地根据血流动力学情况,为改善恶化的心肌收缩力进行精确地调整,对心脏功能的失代偿进行更为准确的预估和预防。
第三,左室心内膜电极有比心外膜电极更生理和不易诱发心律失常的优点。植入左室心外膜电极的一些病例常常出现室性心律失常。这是因为其逆转了透壁的激动顺序,并使心内膜的除极和复极延迟。在动物模型中,这个激动顺序逆转增加了多源传导和透壁复极的离散度,从而形成折返,并且延长Q-T间期,增加间端扭转性室速的风险。左室心内膜电极的刺激是正常透壁的除极顺序,降低了心律失常风险。
第四,标准的双心室同步治疗预期可能出现30%患者对治疗无反应。左室心内膜电极植入可以降低无反应的发生。Garrigue S等观察17例经冠状静脉窦植入电极患者和8例经穿刺房间隔植入左室心内膜电极患者。6个月随访,超声心动图显示,相比心外膜植入电极患者,心内膜植入电极患者心室同步性增加更显著,左室射血分数提高,左室内压变化速率(dP/dtmax)增大。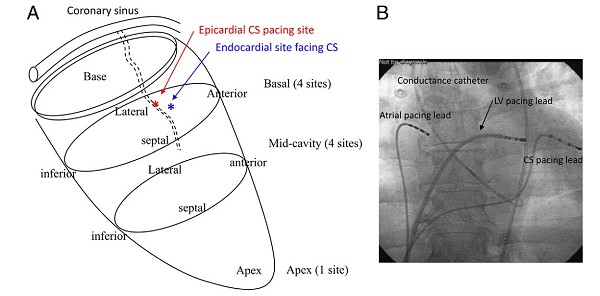
动物实验及人体研究证据
van Denren 等对实验动物(狗)进行了左束支射频消融处理,并分别给予左室内膜起搏和左室外膜起搏。观察内容包括左室压力最大、最小变化速率,中风发生率,心电非同步性,复极的离散度。证实经左室心内膜电极植入显著优于比心外膜电极植入。首先,与心外膜电极植入相比,心内膜电极刺激可以降低复极的透壁离散度,维持除极由心内膜向心外膜的生理顺序。心内膜电极比心外膜电极更少引起心律失常。第二,心内膜电极植入可以降低左室非同步性,缩短左室激动时间。CRT治疗慢性心力衰竭有效的关键在于心室非同步性的改善,心内膜起搏比心外膜起搏有更快的传导,心内膜电极起搏依靠很短的中心式的传导,而心外膜电极起搏会有更长的周长。第三,与相对应的心外膜电极相比,心内膜电极植入可以提高左室dP/dtmax90%。第四,在植入左室心外膜电极的情况下,不同的起搏部位带来不同的血流动力学反应。心尖部植入比心底部植入有更显著的优越性。相反,不同心内膜起搏位置的血流动力学反应相似。同样,心内膜电极起搏的血流动力学反应较心外膜更少地依靠房室延迟的优化调整。该项研究针对的是急性左束支传导阻滞的心室失同步模型,与心力衰竭的临床和电生理特征有所不同,但是其侵入性检查结果证实心内膜起搏的血流动力学检测毫无疑问地优于心外膜起搏。
短期血流动力学变化显著
Derval N等最近完成了一项对比经冠状静脉窦植入心外膜电极和左室心内膜电极植入的短期血液动力效果的研究。入选同种族35例非缺血心肌病和非瓣膜病且符合CRT植入标准的患者。经冠状静脉窦分别在心底部,中间隔,前壁,侧壁,下壁等部位起搏,与之相对应的心内膜位置起搏进行对比。检测血液动力学指标dP/dtmax, dP/dtmin,脉压,左室舒张末期压力。
从中可以得出的结论包括以下几个方面:第一,该研究对比了不论优劣起搏位点的心内膜和心外膜起搏的不同情况,发现两者的+dP/dtmax,脉压和收缩末压无显著差异,心内膜起搏在不同的房室延迟下,-dP/dtmin均优于心外膜起搏。说明心内膜起搏的优越性主要体现在对于舒张期的作用,而不是收缩期。第二,最佳和最差的起搏位点存在非常广泛的个体差异,11个起搏位点中最佳和最差的分布相当均等。例如,左室侧壁的心外膜起搏在9%的患者是最佳位点,而在17%的患者却受益最少。第三,接受CRT植入的患者的起搏位置选择个体差异大。第四,理想起搏位置通常会带来各项检测指标的显著改善。经冠状静脉窦分支起搏心室侧壁,对照基线只有15%的改善,而经最佳起搏位置起搏会有30%的改善。因此,最佳的起搏位置可能比标准的心外膜心室侧壁起搏有双倍的血流动力学改善。这个结论对标准的心外膜心室侧壁起搏无获益的患者尤为重要。第五,还有接近10%的患者,血流动力学没有改善,与CRT短期无反应有关。
LVES的技术途径
左心室心内膜电极植入技术有三条途径,经穿刺房间隔途径,经主动脉途径,以及经心尖部途径。
经穿刺房间隔途径,需要穿刺房间隔,电极经右心房进入左心房,再经二尖瓣进入左心室。永久性穿间隔左室心内膜电极植入应用经上、下混合静脉入路。在1998年,Jais P等进行了第一例永久性穿间隔左室心内膜电极植入,应用了经右侧颈内静脉和股静脉的混合入路。经股静脉植入鞘管穿刺房间隔进入左房,经颈内静脉送入导丝,抓捕导丝送入左心房。沿导丝置鞘管入左心房,经鞘管送入起搏电极。另外一些法国研究者采取了直接经右侧颈内静脉穿刺房间隔方式植入左心室电极。该方法没有专用的设备可以应用,根据个体和解剖的不同情况给予调整。经颈内静脉的入路,因为缺少经典的识别卵圆窝的解剖学标志,皮下隧道的制作表浅且较长,更易出现皮肤和电极损伤,而更具挑战性。
房间隔穿刺一般多采用右侧股静脉入路,一些术者也采用混合入路,经右侧股静脉行房间隔穿刺,经锁骨下静脉植入电极。应用穿间隔的方法植入左室电极,不管实际操作情况如何,在程序上理论上成功率是很高的。而且根据已发表的报告,通过长期观察,并发症较少,电极的长期稳定性好,阈值稳定,这些都是令人振奋的消息。而且心脏电生理工作者对于经房间隔进入左心房的导管技术较为熟悉,在旁道、室性心动过速的消融,肺静脉电隔离术中已广泛应用该技术,实施电极植入也会得心应手。
经腋、锁骨下动脉途径跨主动脉瓣的途径进行左室心内膜电极的植入只有较少报道,Reinig M等在一例以猪为模型的研究中经右侧颈动脉植入左室电极,研究经主动脉入路植入的安全性和可行性。6个月起搏后,没有抗凝的情况下,没有发生血栓栓塞并发症,出现较轻的主动脉瓣关闭不全,处死动物后检查中未发现主动脉瓣损伤。在人类一般首选锁骨下 而不是颈动脉,跨主动脉瓣植入电极的长期风险和影响还有待于进一步查明。
经心尖部途径植入左室心内膜电极的方式是匈牙利研究者Kassai I等在2008年发表的,经局限性胸廓切开术,应用Seldinger技术穿刺心尖部,送入主动固定电极至左室心腔,在放射线指导下定位,固定电极,制作隧道至脉冲发生器囊袋。由于该方法不经过二尖瓣,出现二尖瓣关闭不全的风险极小,但因其只在有限的几例患者应用,长期安全性和有效性有待进一步验证。
反方观点:LVES,CRT必须放弃的选择
LVES与血栓栓塞
血栓栓塞并发症是该项操作的最主要并发症。右心室血栓可以导致肺栓塞,左心室血栓可以导致包括脑血管栓塞事件在内的更为严重的体循环系统并发症。另外,在心力衰竭并有肺动脉高压的患者,如果存在心房间的孔隙,更易形成栓塞。
左室起搏电极植入预防血栓栓塞并发症要面临较多问题。首先,植入过程中应有效地肝素化,增加了术后出血、血肿的风险,另外,长期系统地抗凝治疗既面临不恰当地终止造成血栓的风险,又面临过量出血的风险,在血栓和出血之间很难找到理想的平衡点。第三,左室电极植入对器械的低致血栓形成性能要求更高,暂时还没有专门的心内膜电极生产,应用现有设备有较高风险。第四,现阶段的电极和房间隔穿刺术所应用的鞘管系统没有精确地匹配,很容易在房间隔穿刺中造成不能关闭的心房间的孔隙,从而加重血栓栓塞的风险。
LVES与感染并发症
LVES方式的CRT过程中,左室心内膜电极对二尖瓣具有损伤作用。经房间隔穿刺植入左室电极要跨二尖瓣,势必造成与二尖瓣的冲突,加重二尖瓣关闭不全和增加感染并发症——感染性心内膜炎的几率。从相关报道看加重二尖瓣关闭不全的经间隔植入电极的病例并不多见,植入CRT的患者出现不同程度的二尖瓣关闭不全的其他原因包括缺血性心脏病和瓣环扩张。近年来,二尖瓣感染性心内膜炎的发生率增加,应更加重视。与感染的电极导线接触加重二尖瓣的感染性心内膜炎。继发于二尖瓣感染性心内膜炎的赘生物较右心系统更易引起脑、肾脓肿。感染性心内膜炎的治疗措施只能选择外科手术,这对于重度心力衰竭的患者来说可能是致命的。
与左室心内膜电极取出相关的风险较高。由于赘生物、栓子、电极上的纤维能够造成系统栓塞并发症,经皮取出电极的危险更高。现今的标准装置无法适应左室心内膜电极的取出。右室电极的取出有时损伤三尖瓣,左室电极的取出的损伤更为严重,可能损伤房间隔和二尖瓣。在一些并不复杂的电极取出病例,也可能面临外科手术的风险。
目前看来,由于LVES方式CRT治疗过程中上述严重并发症的<[下一页] [1] [2]